2.1 Вступление
Диетарная клетчатка (пищевые волокна) – это углеводы (натуральные и синтетические), которые не подвергаются процессам пищеварения в тонком кишечнике человека и несут в себе физиологическую ценность для организма [3,4]. Клетчатка добавляет диете объем, уменьшает энергетическую плотность пищевых продуктов, может улучшать гликемический контроль и предотвращать или уменьшать запоры [3,5]. Большое количество людей не потребляют диетарную клетчатку в достаточном рекомендуемом объеме во многих странах [3,5]. Хорошими источниками диетарной клетчатки служат: цельные зерна, орехи и семена, овощи и фрукты [3,5]. Большее потребление клетчатки связано со снижением риска развития некоторых хронических заболеваний, включая болезни сердечно-сосудистой системы и диабет, также оно может уменьшить риск общей смертности [5–9]. Диетарная клетчатка может быть включена в нутриционный перечень на упаковке пищевых продуктов, обычно она обозначается как подраздел общих углеводов.

2.1.1 Типы диетарной клетчатки
Пища в естественном состоянии содержит смесь растворимых и нерастворимых пищевых волокон (клетчатки), и оба этих типа обладают важными положительными эффектами в контексте диеты, богатой клетчаткой [3,5]. Ранее предполагалось, что физиологический эффект клетчатки обусловлен ее растворимостью, но данные недавних исследований позволяют предположить, что более важны другие ее свойства, особенно ферментируемость и вязкость, а растительные компоненты (такие как антиоксидантные компоненты), связанные с диетарной клетчаткой, также могут вносить свой вклад в снижение риска развития заболеваний [5,13].
2.1.2 Положительные эффекты диетарной клетчатки
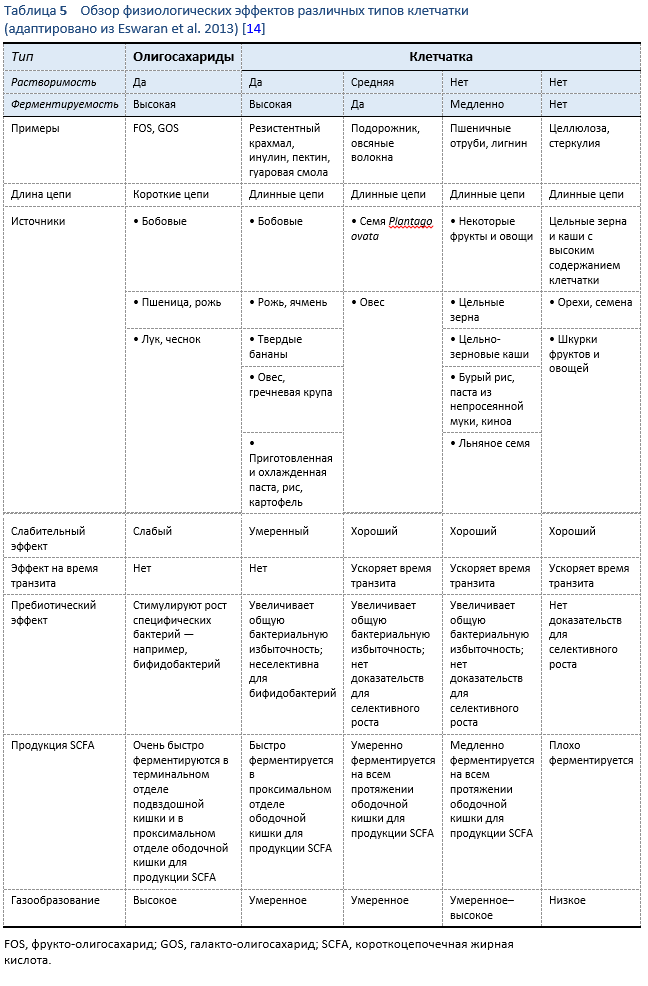
Обзор физических характеристик и физиологических эффектов естественных пищевых волокон см. в Таблице 5. Ниже приведен список доказанных положительных физиологических эффектов, связанных с применением диеты с высоким содержанием клетчатки [12]:
- Снижение в крови уровня общего холестерина и/или липопротеина низкой плотности (ЛПНП)
- Снижение уровня глюкозы в крови после приема пищи и/или уровня инсулина
- Увеличение объема стула и/или снижение времени транзита
- Увеличение продукции короткоцепочечных жирных кислот за счет ферментации кишечной микробиотой
В дополнение к этому, следующие физиологические эффекты диетарной клетчатки считаются вероятными, но требуют дальнейших поддерживающих научных доказательств [12]:
- Снижение артериального давления
- Повышение чувства сытости
- Снижение веса/уменьшение ожирения
- Позитивная модуляция кишечной микробиоты
2.1.3 Взаимодействие диетарной клетчатки с микробиотой кишечника
Полученная с пищей клетчатка может влиять на профиль кишечной микробиоты, вызывать изменения в комплексной среде желудочно-кишечного тракта и способствовать росту бактерий в целом и потенциально полезных бактерий в частности [14–16]. Таким образом, олигосахариды, включая фрукто- и галакто-олигосахариды, инулин и, возможно, другие растворимые пищевые волокна, расцениваются как пребиотики, которые могут стимулировать предпочтительный рост лактобактерий, бифидобактерий и других полезных микроорганизмов в толстом кишечнике [3,14–16]. Предполагается, что кишечная микробиота играет ключевую роль в состоянии здоровья человека и предотвращении развития заболеваний посредством разнообразных механизмов, включающих продукцию короткоцепочечных жирных кислот (SCFA), которые важны для поддержания гомеостаза кишечника и оптимальной работы иммунной системы [3,14–16]. Изменения в среде кишечника связаны со многими часто встречающимися состояниями, такими как синдром раздраженного кишечника, ожирением, сердечно-сосудистыми заболеваниями и астмой [15,16]. Отношения между кишечной микробиотой, диетарной клетчаткой и состоянием здоровья представляют собой область быстро растущего интереса, но для подтверждения связей, выявленных в ходе исследований на животных и эпидемиологических исследований, требуется проведение хорошо контролируемых исследований на человеке [15,16].
2.2 Роль диетарной клетчатки при различных состояниях желудочно-кишечного тракта
2.2.1 Запор
- Увеличение количества клетчатки в диете уже давно рассматривается как метод лечения первой линии при запорах [3,17,18].
- Увеличение количества жидкости в диете уже давно рассматривается как метод лечения первой линии при запорах [3,17,18]; доказательства, подтверждающие это положение – смешанного характера.
- Улучшение в частоте кишечных сокращений и консистенции стула можно наблюдать при постепенно увеличивающемся количестве диетарной клетчатки (или при применении добавок клетчатки) до целевой дозы в 20–30 гр общей диетарной и/или добавочной клетчатки в сутки. Клетчатка должна добавляться в диету постепенно в течение недель (не дней) для того, чтобы организм успел к ней адаптироваться [18,19].
- Предполагается, что частота стула увеличивается с помощью растворимых пищевых волокон посредством увеличения объема и веса каловых масс, а с помощью нерастворимой клетчатки за счет ускорения транзитного времени прохождения через кишечник; тем не менее, для обоих механизмов отсутствуют высококачественные доказательства, особенно для нерастворимой клетчатки [14].
- Наилучшими доказательствами эффективности среди добавок обладает подорожник при ведении хронической констипации [18].
- Доказательства эффективности клетчатки частично отсутствуют для индивидуальных подтипов запоров: метаболического, неврологического, связанного с диетой, миогенного, связанного с приемом лекарств и для дисфункции тазового дна [14].
- У пациентов с обструктивными заболеваниями кишечника применения диеты с высоким содержанием клетчатки следует избегать.
- Отсроченный транзит по толстому кишечнику или диссинергическая дефекация могут наблюдаться, когда пациенты после потребления клетчатки испытывают значительное усиление симптомов, связанных с запорами [17,20,21].
Заключение: Диета с высоким содержанием клетчатки может служить средством защиты при запорах и использоваться при их лечении. Рекомендуется постепенное увеличение количества клетчатки в диете и в виде добавок до 20–30 гр/сут с адекватным количеством жидкости. Дополнительно, при ведении хронической констипации может быть целесообразным добавление подорожника. Роль клетчатки при других формах запоров ограничена, а у некоторых пациентов диета с высоким содержанием клетчатки может вызвать ухудшение симптоматики.
2.2.2 Синдром раздраженного кишечника (СРК)
- Эффекты клетчатки на симптомы СРК разнообразны и специфичны для каждого типа клетчатки [14,22,23].
- Растворимые добавки — включая льняное семя, метилцеллюлозу, парциально гидролизованную гуаровую смолу и подорожник — продемонстрировали терапевтический эффект во многих клинических испытаниях, особенно у пациентов с СРК с преобладанием запоров (СРК-З) [3,14,22,23].
- Высоко ферментируемые пищевые волокна, такие как олигосахариды, инулин и пшеничные отруби (благодаря их олигосахаридному содержимому) могут способствовать усилению газообразования, таким образом усиливая симптомы вздутия живота, метеоризма и желудочно-кишечного дискомфорта при СРК [14,22,23].
- Снижение потребления высоко ферментируемой клетчатки, как часть диеты с низким содержанием FODMAP (см. раздел 3), рекомендуется при ведении СРК и обеспечивает уменьшение симптоматики приблизительно у 75% пациентов [14,22].
Заключение: Высоко ферментируемые пищевые волокна, такие как олигосахариды, инулин, а также пшеничные отруби могут усиливать симптомы СРК. Существуют достоверные данные, показывающие, что снижение потребления высоко ферментируемой клетчатки, как часть диеты с низким содержанием FODMAP (см. раздел 3), эффективно для уменьшения симптомов у большинства пациентов с СРК. Напротив, растворимые добавки клетчатки, например подорожник, льняное семя и метилцеллюлоза могут иметь терапевтический эффект, особенно при СРК-З.
2.2.3 Воспалительная болезнь кишечника (ВБК)
- Доказательства терапевтического эффекта диетарной клетчатки при ВБК отсутствуют. Тем не менее, учитывая потенциальные противовоспалительные и иммуномодулирующие эффекты клетчатки, данная тема требует дальнейшего изучения [24].
- Запрета на диетарную клетчатку при ВБК не требуется, за исключением случаев выраженного стеноза кишечника [24].
- Снижение потребления высоко ферментируемой клетчатки, как часть диеты с низким содержанием FODMAP, может быть полезным при симптоматическом ведении пациентов с ВБК в сочетании с СРК (см. раздел 3) [25,26].
Заключение: В настоящее время не достаточно доказательств, подтверждающих терапевтическую роль диетарной клетчатки при ВБК. Следовательно, требуется проведение дальнейших высококачественных исследований. Пациентам с ВБК не должно быть запрещено потребление диетарной клетчатки, за исключением случаев выраженного стеноза кишечника. Пациентам с ВБК в сочетании с СРК может принести пользу уменьшение потребления высоко ферментируемой клетчатки, как части диеты с низким содержанием FODMAP.
2.2.4 Дивертикулярная болезнь
- Увеличение потребления диетарной клетчатки может быть связано со снижением риска развития дивертикулярной болезни [27,28].
- Пока не ясно, полезна ли диета с высоким содержанием клетчатки пациентам с дивертикулезом, поскольку его патогенез вероятно является мультифакторным и сложным. Необходимо проведение большего количества исследований для оценки роли клетчатки в патогенезе и лечении дивертикулярной болезни [27,28].
- Результаты нескольких исследований невысокого качества позволяют предположить, что употребление клетчатки может улучшить симптоматику, связанную с неосложненным дивертикулезом и снизить риск развития дивертикулита. Тем не менее, доказательства высокого качества отсутствуют [27,28].
- Во время эпизода острого дивертикулита часто рекомендуется диета с низким содержанием клетчатки для минимизации раздражения кишечника [27,28]. Тем не менее, в поддержку этой стратегии имеются только ограниченные доказательства.
Заключение: Применение диеты с высоким содержанием клетчатки может иметь защитную функцию против развития дивертикулярной болезни, а риск осложнений (дивертикулита) может быть выше при диете с низким содержанием клетчатки. Кратковременное назначение диеты с низким содержанием клетчатки может быть показано в случаях дивертикулита. Тем не менее, все эти рекомендации поддерживаются только ограниченными доказательствами и мнениями экспертов.
2.2.5 Колоректальный рак
- Доказательства того, что клетчатка снижает риск развития колоректального рака носят смешанный характер, необходимо проведение дальнейших исследований [29].
- Проведенный в 2012 г. анализ исследования EPIC (Европейское Проспективное Исследование Рака и Питания) показал, что общее количество диетарной клетчатки обратно связано с риском развития колоректального рака, с подобными же результатами для рака ободочной кишки и рака прямой кишки. Сходным же образом диетарная клетчатка из злаков, фруктов и овощей связана с уменьшенным риском развития рака ободочной кишки [30]. Только злаковая клетчатка связана с пониженным риском рака прямой кишки [30].
- Нет доказательств, полученных в рандомизированных контролируемых исследованиях (РКИ), позволяющих предположить, что повышение количества диетарной клетчатки снижает частоту или развитие рецидивов аденоматозных полипов в течение 2-8-летнего периода [31]. Для дальнейшей оценки такого влияния необходимо проведение исследований с более длительным периодом наблюдения [31].
Заключение: Доказательства, полученные в когортных исследованиях, в основном указывают на наличие протективного эффекта диеты с высоким содержанием клетчатки при колоректальном раке; тем не менее, нет уверенности в том, имеется ли в данной ситуации связь между причиной и эффектом. Требуются дальнейшие высококачественные исследования для выяснения связи и идентификации потенциальных механизмов действия.
2.2.6 Клинические показания для назначения диеты с низким содержанием клетчатки
- Употребление пищевых продуктов с низким содержанием клетчатки может помочь в уменьшении диареи, газообразования и метеоризма за счет снижения частоты кишечных сокращений и уменьшения ферментации в толстом кишечнике [32].
- Кратковременное применение диеты с низким содержанием клетчатки (< 10 гр/сут) может рекомендоваться для очищения кишечника перед диагностическими процедурами, такими как колоноскопия, колонография и перед лапароскопическим гинекологическим хирургическим лечением. По сравнению с традиционными методами подготовки кишечника (жидкостная диета с применением слабительных препаратов), в исследованиях показано, что подход с назначением диеты с низким содержанием клетчатки лучше переносим, имеет меньшее количество побочных эффектов и позволяет снизить дозы слабительных препаратов, не ухудшая качество подготовки [32,33].
- Диета с низким содержанием клетчатки часто рекомендована как временная мера при обострениях дивертикулита, болезни Крона или язвенного колита, а также после хирургических вмешательств на желудочно-кишечном тракте. Тем не менее, для окончательного понимания терапевтической эффективности данного метода требуется проведения дальнейших исследований [32]. Несмотря на это, кратковременное применение обладает малым нутриционным риском, особенно если пациент придерживается диеты под наблюдением диетолога [32] и предполагается возвращение к диете с достаточным содержанием клетчатки.
- Рекомендации по диете с низким содержанием клетчатки включают следующее: не употреблять орехи и семена, употреблять хлеб и каши из хорошо просеянной муки, при возможности снизить потребление овощей и фруктов, очищать фрукты и овощи от кожуры [32].
- В некоторых случаях низкое содержание клетчатки не является единственным диетическим фактором при рекомендациях. Пациентам с метеоризмом, болями и другими СРК-подобными симптомами также может быть запрещен прием острой, жирной пищи, продуктов раздражающих кишечник (таких как алкоголь и напитки, содержащие кофеин), а также продукты, к которым имеется индивидуальная плохая переносимость [19].
Заключение: Существуют ограниченные доказательства в поддержку терапевтического использования диеты с низким содержанием клетчатки в отношении заболеваний ЖКТ и хирургических вмешательств. Тем не менее, это часто применяется в клинической практике и имеет малый нутрициональный риск. Диета с низким содержанием клетчатки может использоваться при подготовке кишечника перед диагностическими процедурами и может улучшить согласие пациента на проведение данных действий.
2.3 Потребление клетчатки и рекомендации
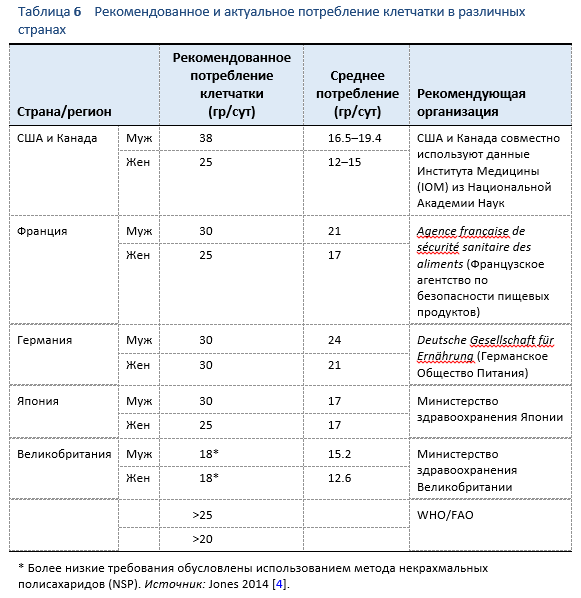
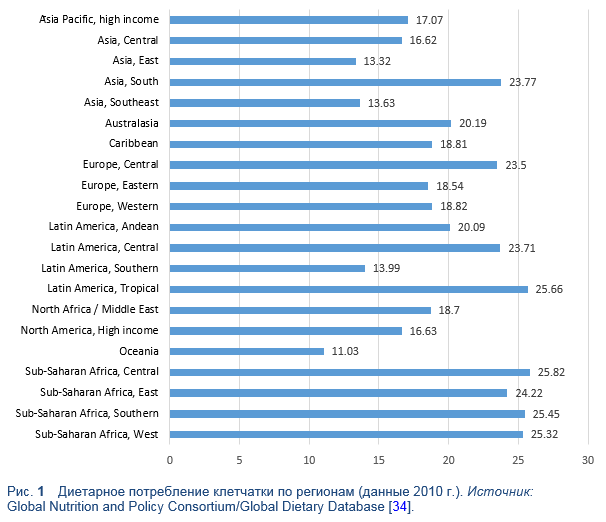
Целевые значения количества рекомендуемого потребления клетчатки могут варьировать по всему миру (Таблица 6). Тем не менее, в практических рекомендациях обычно присутствует количество > 20 гр/сут [4,5]. Актуальное потребление диетарной клетчатки во многих странах ниже рекомендованного количества, в регионах с преобладанием в диете растительной пищи оно значительно выше, например в Африке южнее Сахары (Рис. 1) [3–5].
2.4 Устранение “дефицита клетчатки”
Адекватное потребление клетчатки может быть достигнуто повышением разнообразия в ежедневной схеме приема пищи [5]. Съедание по меньшей мере 400 гр или пяти порций фруктов и овощей в день снижает риск развития хронических заболеваний и обеспечивает адекватное ежедневное потребление клетчатки [11,35]. Понимание необходимости повышенного потребления пищи с высоким содержанием клетчатки, такой как цельные зерна, бобовые, фрукты и овощи, должно широко поддерживаться профессионалами в области пищи и питания [5,35].
Хотя потребители также обращают внимание на пищевые добавки клетчатки и слабительные средства, увеличивающие объем стула, как на дополнительные средства, лучшим способом является получение клетчатки с пищей. Только немногие добавки были исследованы на их физиологическую эффективность [5]. Слишком быстрое увеличение количества клетчатки в диете может привести к развитию неприятных симптомов, таких, например, как повышенное газообразование, вздутие живота, болевые схватки, поэтому всегда рекомендуется постепенное ее наращивание [5].
Хорошими источниками диетарной клетчатки являются: цельнозерновые продукты, фрукты, овощи, фасоль, горох и другие бобовые, орехи и семена. Продукты, обозначенные как имеющие «высокое содержание клетчатки», обычно содержат как минимум 5 гр клетчатки на порцию. Тем не менее, требования, предъявляемые к информации о содержании продукта, различаются в разных странах [4,5].
Примеры широко распространенных продуктов с высоким содержанием клетчатки [36]:
- ½ чашки красной фасоли, приготовленной (6.5 гр клетчатки)
- ½ чашки каши из пшеничных отрубей (9.1 гр клетчатки)
- 1 чашка орехового сквоша, запеченного (6.6 гр клетчатки)
- 1 большой апельсин (7.2 гр клетчатки)
- 1 чашка малины (8.0 гр клетчатки)
- 1 чашка спагетти из цельнозерновой муки, приготовленных (5.9 гр клетчатки)
- 1 чашка брокколи, отваренной (5.5 гр клетчатки)
У потребителей имеется интерес к повышению потребления клетчатки, но большое значение приобретает стоимость и желание есть такие продукты. Изменения в диете требуют изменений в сложившихся привычках, которых добиться сложно, несмотря на ожидаемый положительных эффект. Поддержание диетических изменений требует наличия мотивации, способности изменить поведение и дружественной социальной, а также политической среды (Таблица 7) [5,37].
На эволюцию и форму индивидуальных диетических схем на протяжении времени влияют многие факторы и комплексные взаимодействия: размер дохода, цены на продукты питания (доступность здоровой пищи), индивидуальные предпочтения и убеждения, культурные традиции, а также географические, социальные, экономические факторы и факторы окружающей среды [35].

2.5 Каскадные практические рекомендации — диетарная клетчатка
Пожалуйста, см. раздел 1.2 Каскады, Таблица 1.
3.1 Вступление
3.1.1 Что такое диета с низким содержанием FODMAP?
Диета с низким содержанием FODMAP была разработана исследователями Университета Monash в Мельбурне, Австралия для помощи пациентам с синдромом раздраженного кишечника (СРК) [38–40]. Исследования, проведенные по всему миру, на настоящий момент подтвердили ее эффективность при ведение пациентов с симптомами СРК [41–45].
“FODMAP” – это аббревиатура, которая означает: ферментируемые олигосахариды, дисахариды, моносахариды и (and) полиолы.
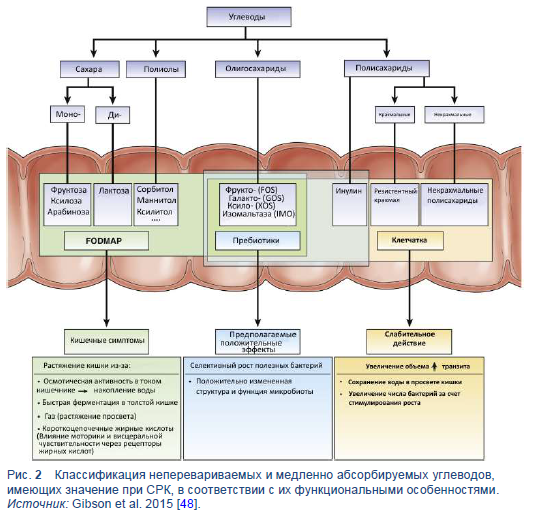
Аббревиатура группирует вместе специфические типы короткоцепочечных углеводов, которые медленно абсорбируются или не перевариваются в тонком кишечнике. За счет своего малого молекулярного размера они посредством осмотического эффекта увеличивают водное содержимое тонкого кишечника, и так как они легко ферментируются бактериями, их перемещение в толстый кишечник вызывает газообразование [38,39,46]. Таким образом, FODMAP могут растягивать (или расширять) кишку. У пациентов с СРК, которые гиперчувствительны к такому расширению, появляются следующие симптомы: абдоминальная боль, вздутие живота, избыточное количество газов и нарушение деятельности кишечника (запор и/или диарея) [47]. Рисунок 2 классифицирует неперевариваемые и медленно абсорбируемые углеводы, в соответствии с их функциональными особенностями [48].
Диета с низким содержанием FODMAP включает уменьшение количества пяти главным подгрупп углеводов:
- Фруктоза в избытке глюкозы — например, мед, манго
- Лактоза (при наличии гиполактазии)— например, молоко, йогурт
- Сахарные полиолы (включая сорбитол и маннитол)— например, авокадо, грибы
- Фруктаны — например, пшеница, лук, чеснок
- Галакто-олигосахариды (GOS)— например, бобовые, соевое молоко
Целью диеты с низким содержанием FODMAP является помощь пациентам в контроле над симптомами и последовательной идентификацией специфических пищевых триггеров. Это достигается посредством уменьшения всех продуктов с FODMAP в диете, после которого проводится стратегическая пищевая провокация. В дальнейшем пациенты уже сами могут вносить в диету модификации. Нет необходимости придерживаться строгой диеты с низким содержанием FODMAP в течение длительного периода.
Содержание FODMAP в широком спектре продуктов было проанализировано Отделением Гастроэнтерологии Университета Monash и результаты были опубликованы в ряде научных статей [49–52]. Полный список содержания FODMAP в продуктах — классифицированное как низкое, умеренное и высокое — доступен через приложение для смартфонов, разработанное университетом [53].
3.1.2 Как применять диету с низким содержанием FODMAP: реинтродукция и проблемы/ограничения
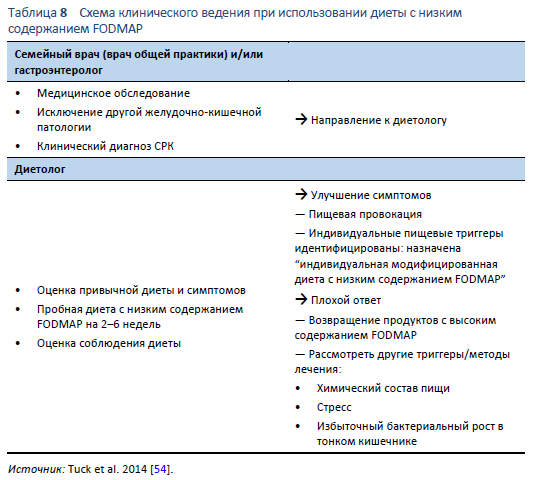
Диету с низким содержанием FODMAP оптимально начинать с помощью опытного диетолога. В Таблице 8 представлен обзор клинического ведения, включая роли семейного врача (врача общей практики) или гастроэнтеролога и диетолога. Диета может быть реализована как трехступенчатый процесс (Таблица 9).
В первую очередь, перед изменением диеты, пациенты должны быть идентифицированы как имеющие функциональные кишечные симптомы, и у них должны быть достоверно исключены другие состояния, такие как целиакия. Это очень важно, поскольку диетические модификации могут повлиять на точность исследований, например, при целиакии. Пациенты должны получить информацию о способах уменьшения продуктов с высоким содержанием FODMAP в диете, обычно на период в 2–6 недель [55]. Первичной целью этой инициальной фазы является уменьшение симптоматики. Лучший для пациентов способ – это получение информации от опытного в области FODMAP диетолога, который должен убедиться, что пациенты понимают какой пищи им следует избегать, и, что очень важно, какие продукты следует употреблять во время инициальной фазы. Нет необходимости исключать целые группы продуктов; вместо этого, модификации должны коснуться типов продуктов из каждой пищевой группы. Например, употребление яблок, в которых имеется высокое содержание FODMAP, можно заменить на употребление апельсинов, в которых содержание FODMAP низкое. Это важно для нутриционной адекватности [55]. Пациенты должны понимать механизмы действия FODMAP и эффекты от их количества для осознания диетарного процесса.
Вторая фаза – это пищевая провокация, целью которой является выявление специфических диетарных триггеров для каждого индивидуума. Маловероятно, что все продукты с высоким содержанием FODMAP вызывают симптомы у каждого человека, и, следовательно, стратегической целью становится определение уровней толерантности для каждой подгруппы FODMAP [56]. Советы диетолога помогут пациенту проверить каждую подгруппу FODMAP, включая ответ на дозу, частоту потребления и дополнительный эффект от разнообразных продуктов с FODMAP [56]. Индивидуальная переносимость FODMAP широко варьирует. Толерантность у каждого человека также может зависеть и от других факторов, включая уровень стресса.
Финальная фаза – это фаза поддержания диеты. Целью данной фазы является возвращение в диету пациента максимально возможного для переносимости количества продуктов с высоким содержанием FODMAP, при одновременном хорошим контролем над симптомами. Любые хорошо переносимые продукты должны быть возвращены в рацион. Умеренно переносимые продукты могут быть возвращены при условии редкого употребления, в то время как плохо переносимых продуктов необходимо полностью избегать [56]. Пациентам, для восстановления толерантности к плохо переносимым продуктам, рекомендуется время от времени их пробовать.

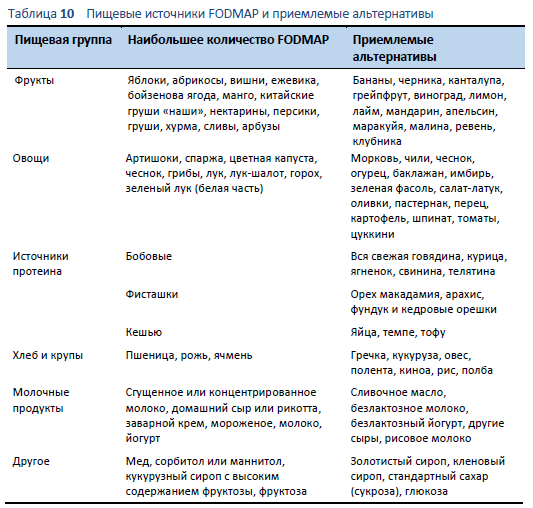
- Список продуктов с высоким содержанием FODMAP и альтернатив с низким содержанием: из-за продолжающихся и быстро прогрессирующих научных исследований диеты с низким содержанием FODMAP, многие из доступных на данный момент списков пищевых продуктов – как печатные, так и on-line – к сожалению устарели и, следовательно, имеют неточности [57]. В Таблице 10 представлен список источник высокого содержания FODMAP и приемлемых альтернатив с низким содержанием FODMAP [58]. Приложение для смартфонов по диете с низким содержанием FODMAP, разработанное в Университете Monash, представляет собой наиболее полезный инструмент, поскольку оно постоянно обновляется [53]. Стоимость приложения - US$ 10, без дополнительной оплаты, включая все обновления.
- Потенциальные побочные эффекты диеты с низким содержанием FODMAP: Любые значительные изменения в диете несут в себе риск нежелательных эффектов, такие как уменьшение количества потребляемой клетчатки или нутриционной неадекватности в целом. Также необходимо помнить о влиянии диетических модификаций на качество жизни. В дополнение к этому, вся съеденная пища является главным фактором в определении желудочно-кишечной микробиоты [59]. Следовательно, существует потенциал, ограничивающий потребление FODMAP, включая пребиотические фруктаны и галакто-олигосахариды, которые могут оказать выраженный эффект на состав микробиоты [60].
На настоящий момент, имеется только ограниченное число опубликованных данных по нутриционной адекватности питания пациентов на толерантность, как при кратковременном назначении диета с низким содержанием FODMAP, так и при возвращении данных продуктов в диету в длительной перспективе. Тем не менее, предполагается, что при адекватном диетологическом наблюдении, диету можно назначать нутриционно адекватным образом. Эффект диеты на нутриционную адекватность при самоназначении не известен [60]. Исследования, проведенные на настоящий момент, позволяют предположить, что общая калорийность, углеводы и потребление кальция могут быть сокращены на короткий период, но потребление клетчатки изменяться не должно. Из-за возможного потенциала влияния диеты на состояние питания, вес тела и количество пищи во время терапии должны мониторироваться [60].
Диета с низким содержанием FODMAP потенциально может улучшать или ухудшать качество жизни человека; тем не менее, большинство имеющихся данных позволяют считать, что она не приводит к ухудшению качества жизни и может даже улучшать его [61]. Недавно опубликованные результаты плацебо-контролируемого исследования пациентов с СРК показывают, что применение диеты с низким содержанием FODMAP связано с адекватным уменьшением симптоматики по сравнению с плацебо [62].
Из-за наличия потенциально вредных эффектов диетической модификации, долговременное применение диеты с низким содержанием FODMAP рекомендовано только пациентам с тяжелыми симптомами, для которых постоянные ограничения необходимы для контроля над симптоматикой.
3.2 Желудочно-кишечные состояния и диета с низким содержанием FODMAP
3.2.1 Показания для назначения диеты с низким содержанием FODMAP
Большинство доказательств эффективности диеты с низким содержанием FODMAP существует для пациентов с СРК. Как было сказано выше, перед назначением диеты важно правильно установить клинический диагноз СРК и исключить другие заболевания.
Существуют определенные доказательства, касающиеся применения диеты с низким содержанием FODMAP у пациентов с воспалительной болезнью кишечника (ВБК) (болезнью Крона и язвенным колитом) [26,63]. У пациентов с ВБК часто отмечаются СРК-подобные симптомы. Применение диеты с низким содержанием FODMAP следовательно направлено на контроль над данными симптомами в большей степени, чем над воспалением, связанным с самим заболеванием. То же самое относится и к целиакии.
Применение диеты с низким содержанием FODMAP в настоящее время исследуется и при других состояниях, таких как эндометриоз [64], детская колика [65], функциональная диспепсия, фибромиалгия [66], склеродерма и синдром хронической усталости. Тем не менее, доказательства эффективности данной диеты при этих состояниях минимальны и, следовательно, на данный момент ее применение не рекомендовано.
3.2.2 Диета с низким содержанием FODMAP, функциональная диспепсия (ФД) и СРК
Существует выраженный перехлест симптомов между СРК и ФД. Функциональная диспепсия характеризуется симптомами вздутия живота, отрыжки, эпигастральной боли и дискомфорта. Многие пациенты одновременно страдают СРК и ФД. Хотя специфические для ФВ данные ограничены, имеются отдельные сообщения об эффективности диеты с низким содержанием FODMAP при ведении данного состояния [67]. Для полной оценки эффективности диеты при ФД требуются дальнейшие исследования.
3.3 Каскадные практические рекомендации—FODMAP
Пожалуйста, см. раздел 1.2 Каскады, Таблица 2.
4.1 Непереносимость лактозы/ дефицит лактазы
4.1.1 Определение терминов
- Лактоза: Дисахарид, который обычно присутствует в молочных продуктах, с наиболее высокой концентрацией в молоке и йогурте.
- Лактаза: Фермент щеточной каемки эпителия, необходимый для расщепления лактозы (дисахарида) на моносахариды глюкозу и галактозу.
- Дефицит лактазы: заметно сниженная, относительно активности у новорожденных, активность каемочной лактазы.
- Мальабсорбция лактозы: Происходит когда значительное количество лактозы не всасывается в тонком кишечнике.
- Непереносимость лактозы: Происходит когда мальабсорбция лактозы вызывает появления желудочно-кишечной симптоматики [68].
4.1.2 Непереносимость лактозы в перспективе: когда это имеет значение?
Экспрессия лактазы происходит по типу обратной связи приблизительно у 65–75% человеческой популяции после прекращения грудного вскармливания. Мальабсорбция лактозы чаще всего встречается в популяциях Азии, Южной Америки и Африки [69]. Персистирование лактазы (продолжающаяся продукция лактазы во взрослом состоянии) – это генетически обусловленная черта, чаще всего встречающаяся в европейской и некоторых африканских, ближневосточных и южно-азиатских популяциях [70].
Уровень исчезновения активности лактазы варьирует в зависимости от этничности. Китайцы и японцы теряют 80–90% активности лактазы в течение 3–4 лет после прекращения грудного вскармливания, по сравнению с 7 годами у евреев и 18–20 годами у северных европейцев [71].
Вторичная непереносимость лактозы может быть вызвана повреждением в тонком кишечнике, как при нелеченой целиакии или вирусном гастроэнтерите. Вторичная непереносимость лактозы обычно обратима после устранения первичного состояния [69].
В отличие от непереносимости лактозы, аллергия на коровье молоко представляет собой воспалительный ответ на молочные белки. Существуют перехлестывающиеся симптомы между непереносимостью лактозы и аллергией на коровье молоко, следовательно, возможна ошибочная диагностика. Аллергия на белки коровьего молока встречается у 2–6% новорожденных и у 0.1–0.5% взрослых [72]. В дополнение к желудочно-кишечной симптоматике, она может приводить к появлению кожных симптомов (эритема, зуд) и проявлениям со стороны дыхательной системы (бронхоспазм, одышка) и даже к анафилаксии [72]. Из-за схожести симптомов для работников здравоохранения важно помнить о различиях между двумя состояниями. Аллергия на коровье молоко также может возникнуть при употреблении молочных продуктов с минимальным содержанием лактозы (например, твердых сортов сыра).
4.1.3 Симптомы непереносимости лактозы
Типичные симптомы непереносимости лактозы включают абдоминальную боль, вздутие живота, метеоризм, диарею и урчание в животе. Также она может приводить к тошноте и рвоте, хотя они возникают реже [69].
У пациентов с простой гиполактазией взрослого типа, количество полученной лактозы, необходимой для возникновения симптомов, варьирует от 12 до 18 гр, или 240 – 360 мл молока. Потребление малого или среднего количества лактозы вызывает появление метеоризма, колик, но не диареи. Употребление большого ее количества ускоряет время эвакуации из желудка и время кишечного транзита, что приводит к развитию более тяжелых симптомов. Несколько факторов определяют начало симптоматики при непереносимости лактозы: ее содержание в пище, время транзита по кишечнику, ферментационная способность кишечной микробиоты, висцеральная гиперчувствительность [73], и (возможно) нейропсихологические факторы [74].

4.1.4 Как диагностировать: в условиях ограниченных ресурсов и достаточных ресурсов
Диагноз непереносимости лактозы основывается на описании пациентом симптомов, возникающих после употребления содержащих ее продуктов [54]. Определение количества лактозы, переносимой пациентом, очень важно для понимания влияния непереносимости на состояние его здоровья [68]. Наличие мальабсорбции лактозы чаще всего не связано с развитием симптомов. Диагноз «непереносимость лактозы» может быть установлен только при их наличии.
- Дыхательный водородный тест на лактозу. Этот тест в настоящее время рассматривается как самое стоимость-эффективное, неинвазивное и достоверное средство определения мальабсорбции лактозы [69]. Дыхательный тест обычно включает прием 25 – 50 гр лактозы, после чего через 3 – 4 часа проводится измерение водорода и метана в выдыхаемом воздухе. Хотя данные в различных практических диагностических рекомендациях варьируют, повышение уровня водорода в дыхание на 20 частей на миллион выше нормы или метана на 10 чнм предполагают наличие мальабсорбции лактозы [69].
- Тест на лактозную «толерантность» [74]. Это – исследование крови на наличие дефицита лактазы, и традиционный термин «толерантность» неправилен. Пациент принимает 50 гр лактозы, растворенной в воде. Забираются образцы капиллярной крови для определения плазменной концентрации глюкозы на −5, 0, 15, 30, 45, and 60 минутах. При наличии мальабсорбции лактозы уровень сахара в крови не поднимется после приема лактозы; обычно, уровень глюкозы в плазме крови должен повышаться минимум до 1.4 ммоль/л (25.2 мг/дл); отсутствие повышения указывает на мальабсорбцию лактозы. Чувствительность теста и специфичность к дефициту лактазы высоки (оба показателя > 90%).
- Генетический тест [74]. Генетический тест идентифицирует одиночный нуклеотидный полиморфизм, связанный с персистенцией/неперсистенцией лактазы. Например, генотип CC коррелирует с гиполактазией, в то время как TT генотип – с персистенцией лактазы. Ни у одного человека с CC генотипом не могут развиться симптомы мальабсорбции лактозы. Тем не менее, изучаются релевантные мутации, зависящие от этничности популяции.
- Биопсия слизистой оболочки кишечника. Биопсия тощей кишки может использоваться для определения активности лактазы, но она менее чувствительна и более инвазивна, чем дыхательный тест на лактозу. В клинической практике проведение биопсии не рекомендуется.
- Пищевая провокация. Диетарной провокации во многих случаях бывает достаточно для идентификации мальабсорбции лактозы. Пищевые продукты, используемые для провокации, должны быть релевантны потребностям и предпочтениям пациента. Стандартная пищевая провокации включает прием 1 стакана (250 мл) обезжиренного молока* за один присест с последующим наблюдением за симптоматическим ответом. Тем не менее, этот метод должен быть адаптирован индивидуально. Например, если конкретный пациент редко употребляет такое количество молока, ему может быть предложено исследование с 200 гр йогурта, который также должен быть обезжиренным* [56].
* Поскольку некоторые люди не переносят молочные жиры (триацилглицерол).
4.1.5 Как лечить
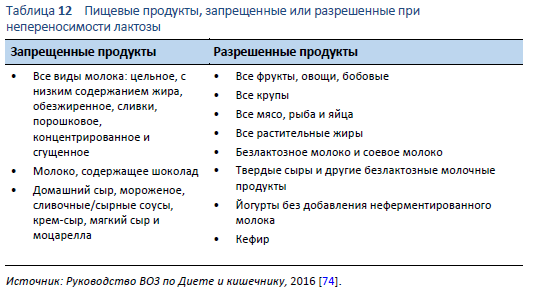
Существует два главных способа лечения непереносимости лактозы: либо путем исключения из диеты пищевых продуктов, содержащих значительное количество лактозы (Таблица 12), либо применением β-галактосидазы для гидролиза лактозного содержимого в пище.
- Модификация диеты — уменьшение количеств лактозы. Большинство пациентов с непереносимостью лактозы могут употребить 12–15 гр лактозы без появления желудочно-кишечных симптомов [68]. Средний молочный продукт содержит приблизительно 12 гр лактозы [75], поэтому малые количества лактозы могут спокойно употреблять даже лица с непереносимостью лактозы. При ведении пациента с непереносимостью лактозы очень важно принимать во внимание количество потребляемой лактозы. Такие молочные продукты как твердые сыры, прекрасный источник кальция, содержат < 1 гр лактозы и, следовательно, должны быть включены в диету пациентов, страдающих непереносимостью лактозы. Пациенты должны обладать правильной информацией о необходимости приема достаточных количеств пищи, содержащей кальций.
Необходимо рассматривать вопрос о снижении количества потребляемой лактозы. Этого можно достичь путем уменьшения продуктов с высоким содержанием лактозы и/или используя безлактозные продукты. Такие молочные продукты как коровье молоко и йогурт могут быть преинкубированы с β-галактосидазой для гидролиза лактозного содержимого. В некоторых странах существует повышающийся спрос на безлактозные продукты, что привело к появлению безлактозного молока, йогурта, сыра, сливок и мороженого. Тем не менее, необходимость безлактозного сыра и сливок находится под вопросом, учитывая минимальное содержание лактозы в этих продуктах [54].
- Добавление ферментов. Альтернативным методом лечения является добавление фермента лактазы (β-галактосидеразы), который принимается орально вместе с пищей. Исследования показали, что данный метод эффективен в отношении показателей водородного теста и в купировании симптомов [76–78], хотя высокое содержание лактозы, такое как 50 гр, по-видимому нивелирует действие фермента [77].
4.2 Непереносимость фруктозы
4.2.1 Определение терминов
- Фруктоза: Моносахарид, присутствующий в меде, манго, яблоках, грушах и кукурузном сиропе.
- Избыточная фруктоза: Обычно фруктоза и глюкоза одновременно имеются в пищевых продуктах; избыточная фруктоза определяется как наличие фруктозы при избытке глюкозы (также носит название «свободная фруктоза»). Абсорбция избыточной фруктозы зависит от путей с низкой абсорбирующей способностью, которые, по всей видимости, присутствуют по всей протяженности тонкого кишечника. В этой ситуации, молекулы фруктозы будут пребывать в тонком кишечнике в течение большего времени и распространять свои осмотические эффекты за его пределы с возможным «забросом» в толстый кишечник (т.е., вызывать мальабсорбцию фруктозы) [46,54]. Фруктоза, достигающая толстого кишечника, становится объектом ферментации, выделяя водород и метан, которые могут определяться в выдыхаемом воздухе.
- Мальабсорбция фруктозы: Неполная абсорбция потребленной дозы фруктозы в тонком кишечнике, приводящая к ее забросу в толстый кишечник. Доказано, что мальабсорбция фруктозы представляет собой нормальный феномен, отмечающийся приблизительно у 35% здоровых людей [79].
- Непереносимость фруктозы: Происходит в ситуации, когда потребление фруктозы вызывает появление желудочно-кишечных симптомов.
4.2.2 Предполагаемые механизмы
- Доказано, что фруктоза обладает осмотическим эффектом, повышающим водное содержимое в просвете тонкого кишечника, что приводит к расширению (растяжению) стенок кишечника. Если этот процесс выражен, или присутствует висцеральная гиперчувствительность, это может привести к возникновению абдоминальной боли, метеоризму и, иногда, к диарее. Как было показано, данный эффект происходит вне зависимости от степени абсорбции фруктозы в тонком кишечнике [46]. Следовательно, вероятнее всего к развитию симптоматики после потребления фруктозы приводит не наличие мальабсорбции, а висцеральная гиперчувствительность, подобная той, что наблюдается при функциональных расстройствах ЖКТ [47].
- Ранее как помощь в таргетировании диетической терапии был популярен водородный дыхательный тест; предполагалось, что при отрицательном результате дыхательного теста на фруктозу пациентам не требовалось ограничивать ее потребление. Тем не менее, симптомы могут возникать за счет эффектов фруктозы на тонкий кишечник, вне зависимости от наличия мальабсорбции, определяемой результатами дыхательного теста с водородом и метаном. Таким образом, в настоящее время для оценки абсорбции фруктозы дыхательное водородное тестирование более не рекомендуется [80].
4.2.3 Потребление фруктозы
Оценки потребления фруктозы позволяют предположить, что общее ее потребление в последние годы выросло, в основном за счет возросшего применения в пищу кукурузных сиропов с высоким содержанием фруктозы. Исследование, проведенное в США и сравнивающее уровни потребления в периоды 1977–1978 гг. и 1999–2004 гг., показало только 1%-ное увеличение фруктозы как части энергетического потребления, по сравнению с увеличением общего потребления углеводов в 41% [74,81]. Это доказывает, что повышение потребления фруктозы не настолько значительно, как предполагалось ранее. Главным диетическим источником фруктозы в 1999–2004 гг. служили фрукты и фруктовые продукты [81].
4.2.4 Использование диетической модификации
Ранее проводимые исследования эффекта избыточной фруктозы на желудочно-кишечный тракт фокусировались только на одной фруктозе или на комбинации фруктозы с сорбитолом. Тем не менее, свободные от фруктозы диеты были плохо описаны. Так как избыточная фруктоза часто потребляется в сочетании с другими короткоцепочечными углеводами, оказывающими похожие эффекты на кишечник (например, FODMAP), в патогенезе расстройств ЖКТ важна комбинированная роль этих специфических углеводов, а не только их индивидуальное действие [49–51]. Группирование этих ферментируемых углеводов как части диеты с низким содержанием FODMAP было связано с улучшением симптоматики у трех четвертей пациентов с функциональными расстройствами ЖКТ [40,41,44,82].
4.2.5 Рекомендации
- Потребление фруктозы (при избытке глюкозы) модифицировано как компонент диеты с низким содержанием FODMAP. Снижение количества всех диетарных FODMAP, а не только фруктозы, обладает большим положительным эффектом на желудочно-кишечную симптоматику.
- «Мальабсорбция фруктозы» - это не диагноз и не состояние. Правильнее будет сказать, что диетарная фруктоза может провоцировать появление СРК-подобных симптомов, и ее эффекты должны учитываться вместе с эффектами других FODMAP (см. раздел 3).
- Клиническая ценность дыхательных тестов для идентификации мальабсорбции фруктозы ограничена.
- Для уточнения пищевых продуктов, которые необходимо избегать, пожалуйста, обращайтесь к таблице состава FODMAP (Таблица 10).
4.3 Дефицит сукразы-изомальтазы
Дефицит сукразы-изомальтазы (также известный как непереносимость сукрозы) обычно проявляется в самом начале жизни и может приводить к мальабсорбции углеводов, вызывая диарею, метеоризм и абдоминальную боль, сходные с симптомами СРК с преобладанием диареи. Причиной дефицита сукразы-изомальтазы является сниженная активность фермента, известного как глюкозидаза, в тонком кишечнике. Обычно фермент вовлечен в процесс переваривания крахмала и сахаров. При снижении активности глюкозидазы углеводы – особенно сукроза – начинают действовать как FODMAP, с повышенной осмотической активностью и ферментацией в кишечнике, что потенциально приводит к развитию симптомов СРК [83]. Роль дефицита сукразы-изомальтазы в позднем начале появления СРК изучена плохо.
4.3.1 Врожденный дефицит сукразы-изомальтазы
При врожденном дефиците сукразы-изомальтазы, мутации в гене сукразы-изомальтазы (SI) приводит к развитию тяжелой симптоматики. Это редкое заболевание. Тем не менее, в недавно проведенных исследованиях были идентифицированы множественные вариации гена SI с редуцированной функцией. Около 2–9% лиц североамериканского и европейского происхождения могут иметь данные изменение, учитывая, что состояние возможно плохо диагностируется [84]. Тем не менее, еще предстоит доказать его предполагаемую патофизиологическую связь с возникновением симптомов при функциональных расстройствах ЖКТ.
4.3.2 Вторичный или приобретенный дефицит сукразы-изомальтазы
Вторичный или приобретенный дефицит также теоретически возможен, но обычно носит преходящий характер. Исследования на животных моделях показали, что ворсинчатая атрофия, такая как встречается при нелеченой целиакии, может приводить к развитию дефицита сукразы-изомальтазы. При лечении ворсинчатой атрофии дефицит должен исчезать [84].
4.3.3 Диагноз
Диагноз дефицита сукразы-изомальтазы у детей может быть установлен на основании результатов биопсии слизистой 12-перстной и тощей кишки, проведенной для оценки активности сукразы, лактазы, изомальтазы и мальтазы [84]. Однако, биопсийные образцы должны быть заморожены немедленно, при нарушении срока заморозки и за счет сложного комплексного процесса замораживания/размораживания образцов для анализа, могут быть получены неверные результаты [85]. Доступны и другие методы диагностики, такие как дыхательный тест на сукрозу, но проведение этого теста у маленьких детей проблематично [85]. В последнее время для идентификации форм врожденного дефицита сукразы-изомальтазы стало доступно генетическое секвенирование [84], хотя его результаты должны рассматриваться в совокупности с клинической картиной. Имеется лишь небольшое количество данных о ценности данного метода у взрослых.
4.3.4 Лечение
По лечению дефицита сукразы-изомальтазы доступны только ограниченные доказательства. Варианты лечения включают диетическое ограничение сахаров и крахмала, хотя этот метод недостаточно изучен. Пациентам назначается инициальная фаза запрета данных продуктов, с последующим их постепенным введением в диету для определения уровня толерантности. Тем не менее, такие диетические ограничения трудно соблюдать и пациенты часто от них отказываются [85]. Альтернативой диетическим ограничениям служит ферментное замещение сакросидазой, которое показало хороший эффект с исследованиях с маленькой выборкой [85,86]. Тем не менее, необходимо отметить, что ферментное замещение достаточно дорого и может быть не доступно по всему миру.
4.4 Каскадные практические рекомедации
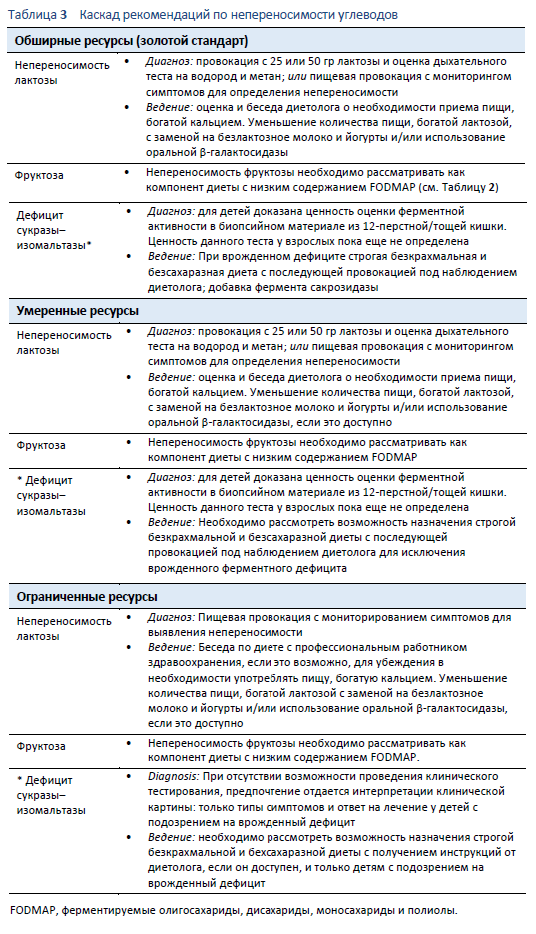
Пожалуйста, обращайтесь к разделу 1.2 Каскады, Таблица 3.
6.1 Аббревиатуры

6.2 Организации, публикующие релевантные практические рекомендации
Практические рекомендации Всемирной Гастроэнтерологической Организации (WGO): Ведение частых желудочно-кишечных симптомов (Hunt et al., 2014) [19]
https://journals.lww.com/jcge/Fulltext/2014/08000/Coping_With_Common_Gastrointestinal_Symptoms_in.4.aspx
http://www.worldgastroenterology.org/guidelines/global-guidelines/common-gi-symptoms
6.3 Ссылки
1. Bai JC, Ciacci C, Corazza GR, Fried M, Olano C, Rostami-Nejad M, et al. Celiac disease. World Gastroenterology Organisation global guidelines [Internet]. Milwaukee, WI: World Gastroenterology Organisation; 2016 [cited 2017 Jul 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/celiac-disease/celiac-disease-english
2. Bai JC, Ciacci C. World Gastroenterology Organisation global guidelines: celiac disease. February 2017. J Clin Gastroenterol. 2017;51(9):755–68.
3. Anderson JW, Baird P, Davis RH, Ferreri S, Knudtson M, Koraym A, et al. Health benefits of dietary fiber. Nutr Rev. 2009;67(4):188–205.
4. Jones JM. CODEX-aligned dietary fiber definitions help to bridge the “fiber gap.” Nutr J. 2014;13:34.
5. Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc. 2008;108(10):1716–31.
6. Kim Y, Je Y. Dietary fiber intake and total mortality: a meta-analysis of prospective cohort studies. Am J Epidemiol. 2014;180(6):565–73.
7. Threapleton DE, Greenwood DC, Evans CEL, Cleghorn CL, Nykjaer C, Woodhead C, et al. Dietary fibre intake and risk of cardiovascular disease: systematic review and meta-analysis. BMJ. 2013;347:f6879.
8. Yang Y, Zhao L-G, Wu Q-J, Ma X, Xiang Y-B. Association between dietary fiber and lower risk of all-cause mortality: a meta-analysis of cohort studies. Am J Epidemiol. 2015;181(2):83–91.
9. Yao B, Fang H, Xu W, Yan Y, Xu H, Liu Y, et al. Dietary fiber intake and risk of type 2 diabetes: a dose-response analysis of prospective studies. Eur J Epidemiol. 2014;29(2):79–88.
10. American Association of Cereal Chemists. The definition of dietary fiber. Report of the Dietary Fiber Definition Committee to the Board of Directors of the American Association Of Cereal Chemists. Submitted January 10, 2001. Cereal Foods World. 2001;46(3):112–26.
11. Livingston KA, Chung M, Sawicki CM, Lyle BJ, Wang DD, Roberts SB, et al. Development of a publicly available, comprehensive database of fiber and health outcomes: rationale and methods. PloS One. 2016;11(6):e0156961.
12. Howlett JF, Betteridge VA, Champ M, Craig SAS, Meheust A, Jones JM. The definition of dietary fiber – discussions at the Ninth Vahouny Fiber Symposium: building scientific agreement. Food Nutr Res [Internet]. 2010 [cited 2017 Jan 15];54. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2972185/
13. McRorie JW, McKeown NM. Understanding the physics of functional fibers in the gastrointestinal tract: an evidence-based approach to resolving enduring misconceptions about insoluble and soluble fiber. J Acad Nutr Diet. 2017;117(2):251–64.
14. Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders. Am J Gastroenterol. 2013;108(5):718–27.
15. Maslowski KM, Mackay CR. Diet, gut microbiota and immune responses. Nat Immunol. 2011;12(1):5–9.
16. Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients. 2013;5(4):1417–35.
17. Christodoulides S, Dimidi E, Fragkos KC, Farmer AD, Whelan K, Scott SM. Systematic review with meta-analysis: effect of fibre supplementation on chronic idiopathic constipation in adults. Aliment Pharmacol Ther. 2016;44(2):103–16.
18. Lindberg G, Hamid SS, Malfertheiner P, Thomsen OO, Fernandez LB, Garisch J, et al. World Gastroenterology Organisation global guideline: Constipation--a global perspective. J Clin Gastroenterol. 2011;45(6):483–7.
19. Hunt R, Quigley E, Abbas Z, Eliakim A, Emmanuel A, Goh K-L, et al. Coping with common gastrointestinal symptoms in the community: a global perspective on heartburn, constipation, bloating, and abdominal pain/discomfort May 2013. J Clin Gastroenterol. 2014;48(7):567–78.
20. Rao SSC, Patcharatrakul T. Diagnosis and treatment of dyssynergic defecation. J Neurogastroenterol Motil. 2016;22(3):423–35.
21. Suares NC, Ford AC. Systematic review: the effects of fibre in the management of chronic idiopathic constipation. Aliment Pharmacol Ther. 2011;33(8):895–901.
22. McKenzie YA, Bowyer RK, Leach H, Gulia P, Horobin J, O’Sullivan NA, et al. British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet. 2016;29(5):549–75.
23. Nagarajan N, Morden A, Bischof D, King EA, Kosztowski M, Wick EC, et al. The role of fiber supplementation in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2015 Sep;27(9):1002–10.
24. Wedlake L, Slack N, Andreyev HJN, Whelan K. Fiber in the treatment and maintenance of inflammatory bowel disease: a systematic review of randomized controlled trials. Inflamm Bowel Dis. 2014;20(3):576–86.
25. Gibson PR. Use of the low-FODMAP diet in inflammatory bowel disease. J Gastroenterol Hepatol. 2017;32 Suppl 1:40–2.
26. Gearry RB, Irving PM, Barrett JS, Nathan DM, Shepherd SJ, Gibson PR. Reduction of dietary poorly absorbed short-chain carbohydrates (FODMAPs) improves abdominal symptoms in patients with inflammatory bowel disease-a pilot study. J Crohns Colitis. 2009;3(1):8–14.
27. Böhm SK. Risk factors for diverticulosis, diverticulitis, diverticular perforation, and bleeding: a plea for more subtle history taking. Viszeralmedizin. 2015;31(2):84–94.
28. Carabotti M, Annibale B, Severi C, Lahner E. Role of fiber in symptomatic uncomplicated diverticular disease: a systematic review. Nutrients. 2017;9(2):161.
29. Asano T, McLeod RS. Dietary fibre for the prevention of colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2002;(2):CD003430.
30. Murphy N, Norat T, Ferrari P, Jenab M, Bueno-de-Mesquita B, Skeie G, et al. Dietary fibre intake and risks of cancers of the colon and rectum in the European prospective investigation into cancer and nutrition (EPIC). PloS One. 2012;7(6):e39361.
31. Yao Y, Suo T, Andersson R, Cao Y, Wang C, Lu J, et al. Dietary fibre for the prevention of recurrent colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2017 Jan 8;1:CD003430.
32. Vanhauwaert E, Matthys C, Verdonck L, Preter VD. Low-residue and low-fiber diets in gastrointestinal disease management. Adv Nutr. 2015;6(6):820–7.
33. Butt J, Bunn C, Paul E, Gibson P, Brown G. The White Diet is preferred, better tolerated, and non-inferior to a clear-fluid diet for bowel preparation: A randomized controlled trial. J Gastroenterol Hepatol. 2016 Feb;31(2):355–63.
34. Global Nutrition and Policy Consortium. Dietary intake of major foods by region, 1990 [Internet]. 2017 [cited 2017 Apr 22]. Available from: http://www.globaldietarydatabase.org/dietary-data-by-region.html
35. World Health Organization. Healthy diet [Internet]. WHO. 2017 [cited 2017 Jan 18]. Available from: http://www.who.int/mediacentre/factsheets/fs394/en/
36. United States Department of Agriculture. Agricultural Research Service. USDA food composition databases [Internet]. 2017 [cited 2017 Apr 21]. Available from: https://ndb.nal.usda.gov/ndb/nutrients/index
37. European Food Information Council (EUFIC). Why we eat what we eat: the barriers to dietary and lifestyle change [Internet]. 2004 [cited 2018 May 19]. Available from: http://www.eufic.org/en/healthy-living/article/why-we-eat-what-we-eat-the-barriers-to-dietary-and-lifestyle-change
38. Ong DK, Mitchell SB, Barrett JS, Shepherd SJ, Irving PM, Biesiekierski JR, et al. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome. J Gastroenterol Hepatol. 2010;25(8):1366–73.
39. Barrett JS, Gearry RB, Muir JG, Irving PM, Rose R, Rosella O, et al. Dietary poorly absorbed, short-chain carbohydrates increase delivery of water and fermentable substrates to the proximal colon. Aliment Pharmacol Ther. 2010;31(8):874–82.
40. Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology. 2014;146(1):67-75.e5.
41. Eswaran SL, Chey WD, Han-Markey T, Ball S, Jackson K. A randomized controlled trial comparing the low FODMAP diet vs. modified NICE guidelines in US adults with IBS-D. Am J Gastroenterol. 2016;111(12):1824–32.
42. Staudacher HM, Lomer MCE, Anderson JL, Barrett JS, Muir JG, Irving PM, et al. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. J Nutr. 2012;142(8):1510–8.
43. McIntosh K, Reed DE, Schneider T, Dang F, Keshteli AH, De Palma G, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial. Gut. 2016;66(7):1241–51.
44. de Roest RH, Dobbs BR, Chapman BA, Batman B, O’Brien LA, Leeper JA, et al. The low FODMAP diet improves gastrointestinal symptoms in patients with irritable bowel syndrome: a prospective study. Int J Clin Pract. 2013;67(9):895–903.
45. Pedersen N, Vegh Z, Burisch J, Jensen L, Ankersen DV, Felding M, et al. Ehealth monitoring in irritable bowel syndrome patients treated with low fermentable oligo-, di-, mono-saccharides and polyols diet. World J Gastroenterol. 2014;20(21):6680–4.
46. Murray K, Wilkinson-Smith V, Hoad C, Costigan C, Cox E, Lam C, et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol. 2014;109(1):110–9.
47. Major G, Pritchard S, Murray K, Alappadan JP, Hoad CL, Marciani L, et al. Colon hypersensitivity to distension, rather than excessive gas production, produces carbohydrate-related symptoms in individuals with irritable bowel syndrome. Gastroenterology. 2017;152(1):124-133.e2.
48. Gibson PR, Varney J, Malakar S, Muir JG. Food components and irritable bowel syndrome. Gastroenterology. 2015;148(6):1158-1174.e4.
49. Muir JG, Shepherd SJ, Rosella O, Rose R, Barrett JS, Gibson PR. Fructan and free fructose content of common Australian vegetables and fruit. J Agric Food Chem. 2007;55(16):6619–27.
50. Muir JG, Rose R, Rosella O, Liels K, Barrett JS, Shepherd SJ, et al. Measurement of short-chain carbohydrates in common Australian vegetables and fruits by high-performance liquid chromatography (HPLC). J Agric Food Chem. 2009;57(2):554–65.
51. Biesiekierski JR, Rosella O, Rose R, Liels K, Barrett JS, Shepherd SJ, et al. Quantification of fructans, galacto-oligosacharides and other short-chain carbohydrates in processed grains and cereals. J Hum Nutr Diet. 2011;24(2):154–76.
52. Yao CK, Tan H-L, van Langenberg DR, Barrett JS, Rose R, Liels K, et al. Dietary sorbitol and mannitol: food content and distinct absorption patterns between healthy individuals and patients with irritable bowel syndrome. J Hum Nutr Diet. 2014;27 Suppl 2:263–75.
53. Monash University. Download the low FODMAP diet app for on-the-go IBS support [Internet]. 2017 [cited 2017 Apr 21]. Available from: http://www.med.monash.edu/cecs/gastro/fodmap/iphone-app.html
54. Tuck CJ, Muir JG, Barrett JS, Gibson PR. Fermentable oligosaccharides, disaccharides, monosaccharides and polyols: role in irritable bowel syndrome. Expert Rev Gastroenterol Hepatol. 2014;8(7):819–34.
55. Barrett JS. How to institute the low-FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:8–10.
56. Tuck C, Barrett J. Re-challenging FODMAPs: the low FODMAP diet phase two. J Gastroenterol Hepatol. 2017;32 Suppl 1:11–5.
57. McMeans AR, King KL, Chumpitazi BP. Low FODMAP dietary food lists are often discordant. Am J Gastroenterol. 2017;112(4):655–6.
58. Barrett JS. Extending our knowledge of fermentable, short-chain carbohydrates for managing gastrointestinal symptoms. Nutr Clin Pract. 2013;28(3):300–6.
59. Payne AN, Chassard C, Lacroix C. Gut microbial adaptation to dietary consumption of fructose, artificial sweeteners and sugar alcohols: implications for host-microbe interactions contributing to obesity. Obes Rev. 2012;13(9):799–809.
60. Staudacher HM. Nutritional, microbiological and psychosocial implications of the low FODMAP diet. J Gastroenterol Hepatol. 2017;32 Suppl 1:16–9.
61. Ostgaard H, Hausken T, Gundersen D, El-Salhy M. Diet and effects of diet management on quality of life and symptoms in patients with irritable bowel syndrome. Mol Med Rep. 2012;5(6):1382–90.
62. Staudacher HM, Lomer MCE, Farquharson FM, Louis P, Fava F, Franciosi E, et al. A diet low in FODMAPs reduces symptoms in patients with irritable bowel syndrome and a probiotic restores bifidobacterium species: a randomized controlled trial. Gastroenterology. 2017;153(4):936–47.
63. Prince AC, Myers CE, Joyce T, Irving P, Lomer M, Whelan K. Fermentable carbohydrate restriction (low FODMAP diet) in clinical practice improves functional gastrointestinal symptoms in patients with inflammatory bowel disease. Inflamm Bowel Dis. 2016;22(5):1129–36.
64. Moore JS, Gibson PR, Perry RE, Burgell RE. Endometriosis in patients with irritable bowel syndrome: specific symptomatic and demographic profile, and response to the low FODMAP diet. Aust N Z J Obstet Gynaecol. 2017;57(2):201–5.
65. Iacovou M, Mulcahy EC, Truby H, Barrett JS, Gibson PR, Muir JG. Reducing the maternal dietary intake of indigestible and slowly absorbed short-chain carbohydrates is associated with improved infantile colic: a proof-of-concept study. J Hum Nutr Diet. 2017;31(2):256–65.
66. Marum AP, Moreira C, Saraiva F, Tomas-Carus P, Sousa-Guerreiro C. A low fermentable oligo-di-mono saccharides and polyols (FODMAP) diet reduced pain and improved daily life in fibromyalgia patients. Scand J Pain. 2016;13:166–72.
67. Tan VP. The low-FODMAP diet in the management of functional dyspepsia in East and Southeast Asia. J Gastroenterol Hepatol. 2017;32 Suppl 1:46–52.
68. Shaukat A, Levitt MD, Taylor BC, MacDonald R, Shamliyan TA, Kane RL, et al. Systematic review: effective management strategies for lactose intolerance. Ann Intern Med. 2010;152(12):797–803.
69. Lomer MCE, Parkes GC, Sanderson JD. Review article: lactose intolerance in clinical practice – myths and realities. Aliment Pharmacol Ther. 2008;27(2):93–103.
70. Itan Y, Jones BL, Ingram CJ, Swallow DM, Thomas MG. A worldwide correlation of lactase persistence phenotype and genotypes. BMC Evol Biol. 2010;10:36.
71. Matthews SB, Waud JP, Roberts AG, Campbell AK. Systemic lactose intolerance: a new perspective on an old problem. Postgrad Med J. 2005;81(953):167–73.
72. Crittenden RG, Bennett LE. Cow’s milk allergy: a complex disorder. J Am Coll Nutr. 2005;24(6 Suppl):582S-91S.
73. Zhu Y, Zheng X, Cong Y, Chu H, Fried M, Dai N, et al. Bloating and distention in irritable bowel syndrome: the role of gas production and visceral sensation after lactose ingestion in a population with lactase deficiency. Am J Gastroenterol. 2013;108(9):1516–25.
74. World Gastroenterology Organisation. WGO handbook on diet and the gut. World Digestive Health Day WDHD — May 29, 2016 [Internet]. Makharia GK, Sanders DS, editors. Milwaukee, WI: World Gastroenterology Organisation and WGO Foundation; 2016 [cited 2017 Mar 24]. Available from: http://www.worldgastroenterology.org/UserFiles/file/WGOHandbookonDietandtheGut_2016_Final.pdf
75. O’Connell S, Walsh G. Physicochemical characteristics of commercial lactases relevant to their application in the alleviation of lactose intolerance. Appl Biochem Biotechnol. 2006;134(2):179–91.
76. Montalto M, Nucera G, Santoro L, Curigliano V, Vastola M, Covino M, et al. Effect of exogenous beta-galactosidase in patients with lactose malabsorption and intolerance: a crossover double-blind placebo-controlled study. Eur J Clin Nutr. 2005;59(4):489–93.
77. Lin MY, Dipalma JA, Martini MC, Gross CJ, Harlander SK, Savaiano DA. Comparative effects of exogenous lactase (beta-galactosidase) preparations on in vivo lactose digestion. Dig Dis Sci. 1993;38(11):2022–7.
78. Rosado JL, Solomons NW, Lisker R, Bourges H. Enzyme replacement therapy for primary adult lactase deficiency. Effective reduction of lactose malabsorption and milk intolerance by direct addition of beta-galactosidase to milk at mealtime. Gastroenterology. 1984;87(5):1072–82.
79. Barrett JS, Gibson PR. Fructose and lactose testing. Aust Fam Physician. 2012;41(5):293–6.
80. Yao CK, Tuck CJ, Barrett JS, Canale KE, Philpott HL, Gibson PR. Poor reproducibility of breath hydrogen testing: Implications for its application in functional bowel disorders. United Eur Gastroenterol J. 2017;5(2):284–92.
81. Marriott BP, Cole N, Lee E. National estimates of dietary fructose intake increased from 1977 to 2004 in the United States. J Nutr. 2009;139(6):1228S-1235S.
82. Staudacher HM, Whelan K, Irving PM, Lomer MCE. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet. 2011;24(5):487–95.
83. Henström M, Diekmann L, Bonfiglio F, Hadizadeh F, Kuech E-M, von Köckritz-Blickwede M, et al. Functional variants in the sucrase–isomaltase gene associate with increased risk of irritable bowel syndrome. Gut. 2018;67:263–70.
84. Cohen SA. The clinical consequences of sucrase–isomaltase deficiency. Mol Cell Pediatr. 2016;3(1):5.
85. Puntis JWL, Zamvar V. Congenital sucrase-isomaltase deficiency: diagnostic challenges and response to enzyme replacement therapy. Arch Dis Child. 2015;100(9):869–71.
86. Harms H-K, Bertele-Harms R-M, Bruer-Kleis D. Enzyme-substitution therapy with the yeast Saccharomyces cerevisiae in congenital sucrase–isomaltase deficiency. N Engl J Med. 1987;316(21):1306–9.
87. Portincasa P, Bonfrate L, de Bari O, Lembo A, Ballou S. Irritable bowel syndrome and diet. Gastroenterol Rep. 2017;5(1):11–9.
88. Ford AC, Vandvik PO. Irritable bowel syndrome: dietary interventions. BMJ Clin Evid. 2015;2015:pii: 0410.
89. Bhat K, Harper A, Gorard DA. Perceived food and drug allergies in functional and organic gastrointestinal disorders. Aliment Pharmacol Ther. 2002;16(5):969–73.
90. Monsbakken KW, Vandvik PO, Farup PG. Perceived food intolerance in subjects with irritable bowel syndrome — etiology, prevalence and consequences. Eur J Clin Nutr. 2006;60(5):667–72.
91. Lacy BE. The science, evidence, and practice of dietary interventions in irritable bowel syndrome. Clin Gastroenterol Hepatol. 2015;13(11):1899–906.
92. Harvie RM, Chisholm AW, Bisanz JE, Burton JP, Herbison P, Schultz K, et al. Long-term irritable bowel syndrome symptom control with reintroduction of selected FODMAPs. World J Gastroenterol. 2017;23(25):4632–43.
93. World Gastroenterology Organisation. Global guidelines [Internet]. 2018 [cited 2018 May 19]. Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines
94. Quigley EMM, Fried M, Gwee K-A, Khalif I, Hungin APS, Lindberg G, et al. World Gastroenterology Organisation global guidelines. Irritable bowel syndrome: a global perspective. Update September 2015. J Clin Gastroenterol. 2016;50(9):704–13.
95. Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, et al. Non-celiac gluten sensitivity has narrowed the spectrum of irritable bowel syndrome: a double-blind randomized placebo-controlled trial. Nutrients. 2015;7(6):4542–54.
96. Eswaran S, Goel A, Chey WD. What role does wheat play in the symptoms of irritable bowel syndrome? Gastroenterol Hepatol. 2013;9(2):85–91.
97. Barmeyer C, Schumann M, Meyer T, Zielinski C, Zuberbier T, Siegmund B, et al. Long-term response to gluten-free diet as evidence for non-celiac wheat sensitivity in one third of patients with diarrhea-dominant and mixed-type irritable bowel syndrome. Int J Colorectal Dis. 2017;32(1):29–39.
98. Aziz I, Trott N, Briggs R, North JR, Hadjivassiliou M, Sanders DS. Efficacy of a gluten-free diet in subjects with irritable bowel syndrome–diarrhea unaware of their HLA-DQ2/8 genotype. Clin Gastroenterol Hepatol. 2016;14(5):696-703.e1.
99. Carroccio A, Mansueto P, Iacono G, Soresi M, D’Alcamo A, Cavataio F, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol. 2012;107(12):1898–906.
100. Carroccio A, D’Alcamo A, Iacono G, Soresi M, Iacobucci R, Arini A, et al. Persistence of nonceliac wheat sensitivity, based on long-term follow-up. Gastroenterology. 2017;153(1):56-58.e3.
101. Skodje GI, Sarna VK, Minelle IH, Rolfsen KL, Muir JG, Gibson PR, et al. Fructan, rather than gluten, induces symptoms in patients with self-reported non-celiac gluten sensitivity. Gastroenterology. 2018;154(3):529-539.e2.
102. Gibson PR, Skodje GI, Lundin KEA. Non-coeliac gluten sensitivity. J Gastroenterol Hepatol. 2017;32 Suppl 1:86–9.
103. Molina-Infante J, Carroccio A. Suspected nonceliac gluten sensitivity confirmed in few patients after gluten challenge in double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol. 2017;15(3):339–48.
104. Moayyedi P, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. The effect of dietary intervention on irritable bowel syndrome: a systematic review. Clin Transl Gastroenterol. 2015;6(8):e107.
105. World Health Organization. WHO guidelines on nutrition [Internet]. WHO. 2018 [cited 2017 Aug 19]. Available from: http://www.who.int/publications/guidelines/nutrition/en/
106. McClave SA, DiBaise JK, Mullin GE, Martindale RG. ACG clinical guideline: nutrition therapy in the adult hospitalized patient. Am J Gastroenterol. 2016;111(3):315–34.
107. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut. 2014;63(8):1210–28.
108. National Institute for Health and Care Excellence (NICE). Diet, nutrition and obesity [Internet]. 2018 [cited 2018 May 19]. Available from: https://www.nice.org.uk/resources/lifestyle-and-wellbeing/diet--nutrition-and-obesity
109. North American Society for Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). Nutrition & obesity [Internet]. 2016 [cited 2018 May 19]. Available from: http://www.naspghan.org/content/55/en/Nutrition-and-Obesity