5.1 Почему целиакию сложно диагностировать?
- Широкий спектр клинических характеристик, которые могут варьировать в течение жизни пациента.
- Симптомы могут наслаиваться на клинические проявления синдрома раздраженного кишечника.
- У пациентов могут иметься в основном внекишечные проявления, или симптомов может не быть вообще.
- Среди врачей (и пациентов) существует плохая осведомленность о целиакии.
- В некоторых географических областях отсутствуют диагностические возможности, например, в тропической Африке.
Существует также несколько «мифов», например:
- Целиакия – редкое заболевание.
- Целиакия бывает:
— только у индоевропейцев
— в основном в Европе и США.
— только в детстве
— только у пациентов с хронической диареей
- Целиакия может быть излечена после (курса) лечения.
- Целиакия – несерьезное заболевание и «проблема исчезает после установления диагноза и назначения безглютеновой диеты».
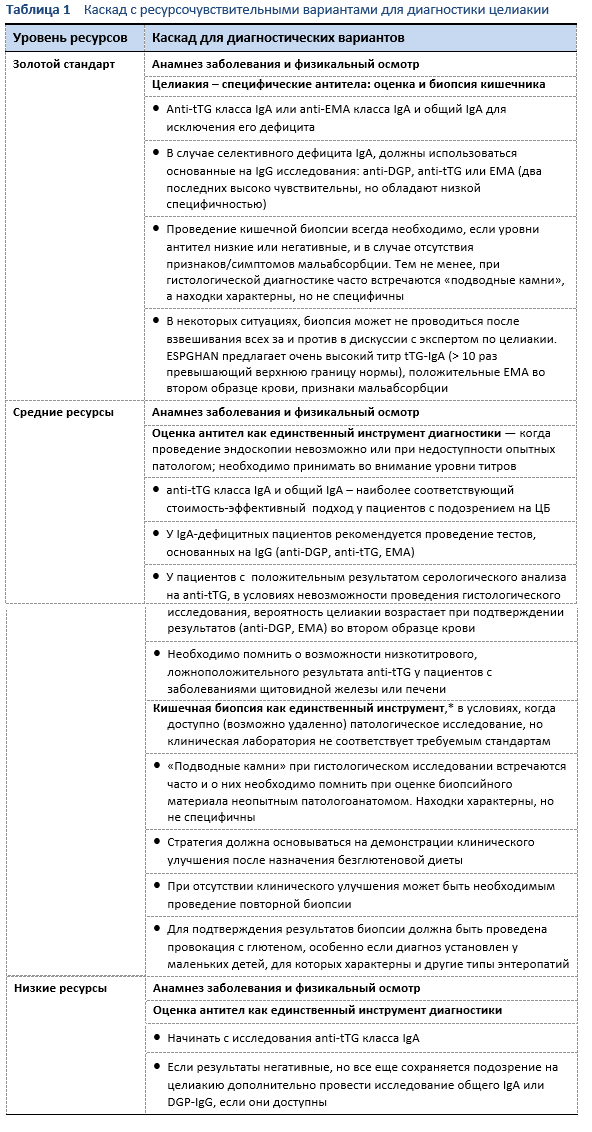
У взрослых и детей диагноз целиакии зависит от наличия положительных специфичных аутоантител и сопутствующего результата исследования образцов биопсии кишечника [15].
У симптомных пациентов с признаками мальабсорбции (классическая целиакия), высоким титром (10 ×) аутоантител (анти-трансглутаминаза), или подтвержденным другими исследованиями (EMA или DGP) в повторном анализе крови диагноз целиакии, он может быть установлен без проведения биопсии слизистой кишечника [62].
- Для подтверждения диагноза у большинства пациентов нет необходимости в повторной (после лечения) биопсии, если первично у них были выявлены положительные результаты серологического исследования и отмечен удовлетворительный эффект при переходе на БГД. Однако среди экспертов или в практических рекомендациях нет широкого консенсуса по этому вопросу [63,64].
- Повторные биопсии должны проводиться пациентам при неубедительных результатах первичной биопсии и серологических тестов (например, при серонегативной энтеропатии) или при отсутствии ответа на назначение строгой безглютеновой диеты [65].
- Глютеновая провокация, при которой назначается прием чистого глютена или глютеносодержащей пищи, проводится пациентам, которые перешли на безглютеновую диету, но диагноз вызывает сомнения [66,67].
5.2 Какие пациенты должны быть обследованы?
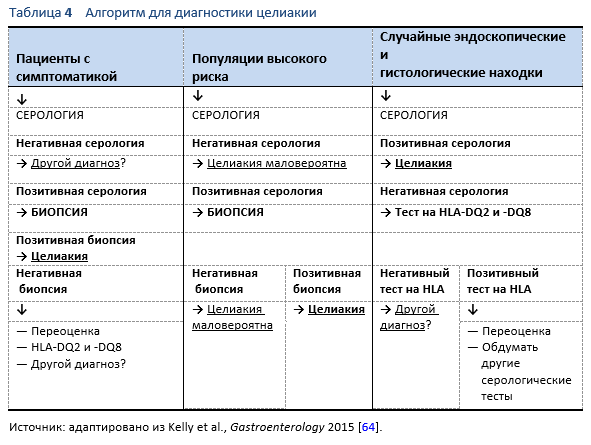
Недавно опубликованный обзор [68] позволяет предположить, что, хотя целиакия соответствует некоторым критериям ВОЗ для массового скрининга, достаточных доказательств в пользу его применения все еще нет, и в настоящее время адекватным подходом является стратегия превентивного выявления случаев заболевания в группах с высоким риском.
5.2.1 Пациенты с клиническими проявлениями, подозрительными на целиакию
- Хроническая или преходящая диарея (например, СРК)
- Железодефицитная анемия
- Задержка развития
- Потеря веса
- Замедление роста
- Задержка пубертатного периода
- Первичная или вторичная аменорея
- Персистирующая усталость
- Высыпания по типу герпетиформного дерматита
- Перелом при неадекватной травме/остеопения/остеопороз
- Бесплодие
- Атаксия
- Необъяснимое повышение трансаминаз
5.2.2 Состояния, связанные с повышенным риском целиакии
- Сахарный диабет тип 1
- Аутоиммунный тиреоидит
- Аутоиммунное заболевание печени
- Синдром Дауна
- Синдром Тернера
- Синдром Вильямса
- Селективный дефицит иммуноглобулина A (IgA)
- Необъяснимое повышение уровня трансаминаз в сыворотке крови
Замечание: Эти состояния могут не быть патогенетически связаны с целиакией, но высокая распространенность заболевания вынуждает к проведению серологического обследования таких пациентов.
5.2.3 Прямые родственники пациентов с целиакией
- Все прямые родственники должны проходить скрининг на целиакию.
- Приблизительно у 7–10% прямых родственников может развиться целиакия, и риск значительно варьирует в зависимости от степени родства с пациентом.
- Риск развития целиакии наиболее высок среди родных сестер и братьев (9%), далее - у детей (8%) и родителей (3%). В то время как сестры и дочери пациента имеют самый высокий риск развития целиакии (одна на семь и одна на восемь, соответственно), у сыновей риск составляет один на 13, у братьев - один на 16, одна на 32 у матерей и один на 33 у отцов. Риск развития заболевания у родственников пациента второй линии выше (2.3%), по сравнению с общей популяцией [69].
- Типирование HLA для всех прямых родственников; если они негативны на HLA-DQ2/8, дальнейшее обследование не проводится. Риск для HLA-DQ2/-DQ8–позитивных лиц варьирует в зависимости от наличествующих аллелей, с самым высоким у гомозигот к DQ2. Сероконверсия к позитивным антителам оценивалась ниже 1% кумулятивно за год, с наиболее высоким уровнем частоты между 12 и 36 месяцами [44].
5.3 Различия в диагностических критериях для целиакии
Диагностические критерии для целиакии могут различаться в разных частях мира из-за нескольких факторов.
- Границы нормы титров для большинства серологических тестов основаны на данных индоевропейской популяции. Границы положительного титра, чувствительности и специфичности могут варьировать в зависимости от возраста, этнического происхождения и региона проживания.
- В то время как целиакия является преобладающей причиной патологии ворсинок слизистой оболочки кишечника среди индоевропейской популяции, во многих странах также значительный вклад в эту гистологическую патологию вносят тропическое спру, паразитарные инфекции и иммунопролиферативные заболевания тонкого кишечника.
5.4 Диагностические тесты
5.4.1 Эндоскопия у пациентов с подозрением на целиакию
Хотя эндоскопия не достаточно чувствительна и специфична [70] для выявления целиакии, следующие находки [71], полученные при ее проведении, могут вызвать подозрение на наличие заболевания:
- Фестончатость дуоденальных складок
- Трещины на складках и мозаичный вид слизистой оболочки
- Уплощение складок
- Уменьшение количества складок, размер и/или исчезновение складок с максимальной инсуффляцией
- Отсутствие ворсинок при увеличении
- Гранулярный вид луковицы двенадцатиперстной кишки
При наличии вышеперечисленных эндоскопических признаков всегда должна быть проведена биопсия слизистой оболочки 12-перстной кишки. Эндоскопическая биопсия должна быть выполнена даже если при осмотре складки выглядят нормальными, но имеются клинические подозрения на наличие целиакии, поскольку нормальный вид складок отмечается у многих пациентов с данным заболеванием. Отсутствие эндоскопических находок имеет низкую прогностическую ценность в выявлении возможности развития целиакии в популяциях низкого риска [64,70].
5.4.2 Биопсия слизистой оболочки кишечника и гистология
Сочетание патологических изменений ворсинок, наблюдаемых при биопсии кишечника, с положительным серологическим тестов является золотым стандартом диагностических критериев для целиакии. Модифицированная классификация Марша для ворсинчатых аномалий сейчас широко применяется в клинической практике для оценки тяжести атрофии ворсинок в слизистой оболочке [63,72,73].
Хотя гистологические изменения, наблюдаемые при целиакии, считаются характерными, они не патогномоничны, поскольку подобные признаки могут встречаться при некоторых других состояниях, включающих тропическое спру, паразитарную инфекцию, различные иммунодефицитные заболевания, энтеропатию при инфекции вирусом иммунодефицита человека (ВИЧ), а также лекарственную и пищевую аллергическую (например, на коровье молоко) энтеропатии.
При целиакии в основном поражается слизистая оболочка проксимальных отделов тонкого кишечника, с тяжестью поражения постепенно уменьшающейся в направлении дистальных отделов, хотя в некоторых случаях они также могут быть затронуты патологическим процессом [20].
Участки поражения в двенадцатиперстной кишке/верхних отделах тощей кишки могут быть фрагментарными, и, как следствие, не попасть в образец, если он не был забран в достаточном объеме. Из второй половины 12-перстной кишки и луковицы должны быть взяты 4 – 6 биопсийных образцов [3]. У пациентов с локально очень ограниченной целиакией патологические изменения могут отмечаться только в луковице 12-перстной кишки — что подчеркивает важность взятия биопсийных образцов из этой области [74]. Биопсии должны быть взяты в тот момент, когда пациент получает диету, содержащую глютен (по меньшей мере, 3 гр глютена в сутки в течение 2 недель) [75]. Негативный гистологический диагноз может оправдать необходимость повторной биопсии у некоторых пациентов с положительными антителами, такими как anti-tTG в высоком титре, anti-DGP и/или эндомизиальные антитела.
Образцы биопсии, взятые из проксимального отдела двенадцатиперстной кишки выше Фатеровой ампулы, могут включать артефакты (например, растяжение ворсинок), образованные подслизистыми железами Бруннера, которые могут ошибочно быть интерпретированы как уплощение слизистой оболочки.
При световой микроскопии самыми характерными гистологическими изменениями [20] у пациентов с целиакией, получающих глютеносодержащую диету, являются:
- Повышенная плотность интраэпителиальных лимфоцитов (> 25/100 эпителиальных клеток)
- Криптовая гиперплазия, с повышенным отношением ворсинки/крипты
- Притупленные или атрофичные ворсинки
- Инфильтрация мононуклеарных клеток в собственную пластинку
- Изменения эпителия, включая структурную патологию эпителиальных клеток
Настоятельно рекомендуется включение в заключение патологоанатома описания изменений в структурированном формате, включая вышеупомянутые гистологические изменения, подсчет интраэпителиальных лимфоцитов, и интерпретацию в терминах модифицированной классификации Марша. Патологи также должны комментировать качество биопсийного образца. При плохом качестве, с маленькими неориентированными фрагментами, патолог должен воздержаться от установления диагноза. В таких случаях необходимо проведение множественных повторных биопсий перед переводом пациента на ограничение потребления глютена.
Серия исследований с хорошим дизайном, проведенных Marsh [20], делает возможным интерпретацию широкого спектра повреждений слизистой оболочки, вызванных глютеном, с гистологическими модификациями, категоризированными от нормальной слизистой до субтотальной/тотальной ворсинчатой атрофии у пациентов с целиакией. Модифицированная классификация Марша широко применяется в клинической практике [73,76]. Для уменьшения разброса трактовок исследователями была предложена другая, более простая, классификация [77].

5.5 Исследования сывороточных антител
Две главные группы серологических маркеров нелеченой целиакии показали себя как высокочувствительные и специфичные [78,79]:
- Аутоантитела, таргетирующие аутоантиген
— Антиэндомизиальные (EMA) антитела и антитела к антитканевой трансглутаминазе (anti-tTG)
- Аутоантитела, таргетирующие чужеродный агент (глиадин)
— Антитела к синтетическим дезамидированным пептидам глиадина (anti-DGPs)
Все эти антитела связаны с иммуноглобулином A (IgA) или иммуноглобулином G (IgG). Говоря конкретно, связанные с IgG тесты используются для выявления целиакии у пациентов с дефицитом IgA.
- У пациентов с низким титром антител и нормальной слизистой оболочкой тонкого кишечника может отмечаться ложноположительный результат исследования. Серологический анализ должен быть проведен повторно через 6 месяцев после перехода пациента на строгую содержащую глютен диету. Если показатель станет негативным, то ситуацию можно расценивать как преходящую серопозитивность. По необходимости длительного динамического наблюдения таких пациентов существует очень мало данных.
- Если серологические результаты остаются положительными, то пациенты могут иметь потенциал для развития целиакии и должны наблюдаться динамически, а результаты первичной биопсии должны быть пересмотрены. У большинства пациентов с потенциальной возможностью впоследствии развивается целиакия.
- В дополнение к этому, у 30% пациентов с герпетиформным дерматитом и позитивной серологией отмечается нормальная гистологическая картина слизистой оболочки. Тем не менее, рекомендуется устанавливать диагноз ГД даже при наличии негативной гистологии на основании позитивных серологических результатов и кожных изменений.
- Бессимптомные пациенты с пограничными показателями титров должны повторно сдавать анализ через 3–6 месяцев на нормальной диете (без исключения или уменьшения количества глютена). Больным с наличием симптомов и пограничными значениями серологических показателей биопсия должна проводиться в любом случае, возможно после увеличения количества глютена в диете.
- Исследования антител против собственного глиадина (AGA-IgA или AGA-IgG) не являются ни чувствительными, ни специфичными для целиакии и не должны применяться [62].
- Исследования для измерения специфичных для целиакии антител в кале, моче и слюне имеют более низкую эффективность по сравнению с анализами крови, и не должны использоваться в клинической практике.
5.5.1 ЭМА класса IgA
Эндомизиальные антитела (ЭМА) класса IgA связаны с эндомизием, соединительной тканью, располагающейся вокруг гладкой мускулатуры, и образующей характерную схему при окрашивании, которая может быть видна при непрямой иммунофлюоресценции [80]. Тесты должны быть оттитрованы, если это возможно; даже низкие титры сывороточных эндомизиальных антител класса IgA специфичны для целиакии. Исследование дорогое, зависимое от выполняющего, трудоемкое и требующего опытного эксперта для правильной интерпретации. Таргетный антиген был идентифицирован как тканевая трансглутаминаза-2. Исследование эндомизиальных антител класса IgA умеренно чувствительно (около 80%) и имеет самую высокую специфичность из всех методов выявления (близкая к 100% специфичность при выполнении исследования опытным экспертом) при нелеченой (активной) целиакии [62,78].
5.5.2 anti-tTG класса IgA
Антитела к tTG высокочувствительны и специфичны для диагностики целиакии [81]. Иммуноферментный метод (ELISA) на выявление антител к tTG класса IgA в настоящее время широко применяется в клинической практике. Он общедоступен и легок в проведении, в меньшей степени зависит от выполняющего его работника и дешевле иммуноферментного анализа, применяющегося для определения ЭМА класса IgA [78,79]. Интересно, что tTG таргетрует тот же самый аутоантиген (TG2), как и ЭМА. Диагностическая точность метода определения anti-tTG IgA улучшилась при применении человеческого tTG, вместо используемого в ранних иммуноферментных наборах нечеловеческого tTG (с меньшей диагностической точностью). Хотя антитела к anti-tTG определяются во всем мире, все еще существует значительное различие в эффективности разных коммерческих наборах для исследования [79].
5.5.3 Антитела к DGP классов IgA и IgG
Метод ELISA, основанный на определении синтетически разработанных деамидированных пептидов глиадина (DGP), был введен в практику несколько лет назад, и клинически испытания показали, что этот метод имеет очень высокий уровень диагностической точности в популяциях с высоким и низким риском. Это было подтверждено и недавно проведенными исследованиями [82].
Аnti-DGP класса IgG эффективнее в диагностике целиакии по сравнению с тестами, основанными на исследовании DGP класса IgA [82–84].
5.5.4 Выбор наиболее соответствующего серологического исследования при различных клинических сценариях
Серологические тесты, специфичные к целиакии, важны для достижения следующих двух целей [78,85]:
1. Подтвердить зависимость от глютена у пациентов с энтеропатией (диагноз)
- IgA-EMA, anti-tTG IgA и anti-DGP IgG and IgA действуют сходным образом, предлагая наиболее ценные заменители для глютеновой зависимости.
- Тесты на основе IgG (anti-DGP, EMA и tTG) представляются очень полезными в ситуации с пациентами с дефицитом IgA и отрицательными результатами соответствующих основанных на нем тестов.
2. Отобрать пациентов для биопсии 12-перстной кишки
Для уменьшения необходимости проведения дуоденальных биопсий и на основании различной точности диагностических серологических исследований применяется серия серологических алгоритмов, позволяющая провести отбор кандидатов на биопсию при разных клинических сценариях.
Выбор серологического теста для скрининга в общей популяции:
- Анализ Anti-tTG IgA, комбинированный с определением общего IgA и основанные на IgG тесты (у пациентов с дефицитом IgA) – наиболее широко используемый алгоритм первой линии для скрининга за счет высокой чувствительности и очень хорошей специфичности.
- Позитивная прогностическая ценность в популяциях с низким риском зависит от уровня титров [86,87]. Пациенты без симптоматики и с низкими показателями титров (например, в три раза ниже верхней границы нормы) должны быть обследованы через 3–6 месяцев диеты с высоким содержанием глютена перед рассмотрением вопроса о проведении эндоскопии и биопсии.
- Таким образом, серологический алгоритм, с серийным применением наиболее специфичных скрининговых методов (например, ЭМА), широко применяется для улучшения диагностической точности в общей популяции [86,88].
- Комбинация тестов может улучшить выявление новых случаев заболевания. Если тесты синхронно положительны, вероятность диагноза целиакии очень высока [85,89,90].
Тест на ЭМА требует толкования опытным экспертом. Следовательно, для определения anti-tTG IgA или IgG anti-DGP при отсутствии надежной экспертизы должны быть рекомендованы ELISA/радиоиммунные методы.
5.6 Генотипирование HLA-DQ2/-DQ8
Генотипирование HLA-DQ2/-DQ8 может служить важным методом для диагностики серонегативного заболевания и для исключения целиакии до проведения формальной глютеновой провокации.
5.7 Предполагаемая БГД
В некоторых географических областях, таких как тропическая Африка, где диагностические возможности отсутствуют или недоступны из-за стоимости, предполагаемая БГД может служить непрямым диагностическим инструментом, если после ее назначения наступает выраженное клиническое улучшение [29]. Такую диету можно с легкостью назначить во многих районах Африка как недорогое средство лечения, не обладающее риском. Основной трудностью является убедить родителей в необходимости назначении диеты истощенному ребенку, особенно если эта диета пожизненная (хотя эта трудность специфична не только для тропиков).
Несмотря на то, что эта стратегия применима в изолированных районах, где она может являться единственным способом подтверждения диагноза и лечения целиакии, мы настоятельно рекомендуем воздерживаться от нее в условиях, где доступно серологическое обследование.
У всех людей, переходящих на безглютеновую диету (по любой причине – например, из-за пищевой аллергии, стиля жизни, СРК), перед ее началом в обязательном порядке должна исключаться целиакия на основании отрицательного результата исследования на специфичные антитела.
5.8 Дифференциальный диагноз
Существует широкий спектр клинических проявлений целиакии, которые могут копировать симптомокомплексы многих других заболеваний желудочно-кишечного тракта. В дополнение к этому, гистологические изменения, позволяющие предположить наличие целиакии, также присутствуют при многих других состояниях, таких как:
- Тропическое спру
- Комбинированные состояния иммунодефицита
- Гиардиоз
- Лекарственная энтеропатия (ольмесартан, микофенолат)
- Энтеропатия при ВИЧ
- Лучевое поражение
- Недавно проведенная химиотерапия
- Болезнь «трансплантат-против-хозяина»
- Хроническая ишемия
- Холера
- Болезнь Крона
- Инфекция Helicobacter pylori
- Эозинофильный гастроэнтерит
- Энтеропатия при пищевой аллергии (у маленьких детей)
- Аутоиммунная энтеропатия
- Тяжелое истощение
5.9 Почему мы должны выявлять целиакию?
У пациентов с симптомами целиакии назначение безглютеновой диеты может привести к выраженному улучшению состояния, качества жизни и нормализации биохимических показателей [91]. Пожизненное лечение также снижает риск развития злокачественных и доброкачественных осложнений. Сохраняются вопросы о долговременных последствиях у пациентов с бессимптомным течением заболевания, а также о необходимости придерживаться пожизненной безглютеновой диеты всем больным. Результаты нескольких исследований позволяют предположить, что пациенты с заболеванием, выявленным при скрининге, большинство которых может расцениваться как бессимптомные, в длительные сроки могут улучшить свое качество жизни, придерживаясь безглютеновой диеты [92,93].
Пациенты с (длительно нелеченой) целиакией имеют повышенный риск развития доброкачественных и злокачественных осложнений, а также повышенной показатель смертности [64,94,95].
- Рак — риск наиболее высок в первые годы после установления диагноза и снижается до (практически) нормальных показателей к пятому году [96], общий интервал риска 1.35
- Злокачественные лимфомы
- Аденокарцинома тонкого кишечника
- Орофарингеальные опухоли
- Необъяснимое бесплодие (12%)
- Поражение костей и нарушения роста (остеопороз 30–40%)
- Переломы костей — повышенный риск - 35% для пациентов с классической симптомной целиакией [97,98]
- У взрослых пациентов с целиакией за счет повышения риска развития злокачественных новообразований повышен риск смертности (отношение рисков, 1.31; 95% доверительный интервал, 1.13 to 1.51 в одном из исследований) [64]
- Патологический исход беременности [99]
В настоящее время единственным методом лечения целиакии является пожизненная строгая БГД [20,66,100,101]. Запрещается употребление пищи или лекарственных средств, содержащих пшеницу, рожь, ячмень или их производные, так как даже малое количество глютена способно причинить вред.
- Удаление глютена (уменьшение ниже уровня 20 мг глютена в сутки) из диеты пациентов с целиакией приводит к возникновению симптоматической, серологической и гистологической ремиссии у большинства больных [84,93].
- Приблизительно 70% пациентов сообщают об уменьшении симптомов в течение 2 недель после перехода на безглютеновую диету [93].
- При приверженности к безглютеновой диете рост и развитие у детей возвращаются к нормальным показателям. Такая диета предотвращает развитие многих осложнений заболевания [102,103].
- При строгой приверженности к диете титр специфичных для целиакии антител нормализуется.
- Хотя ворсинчатые изменения в слизистой оболочке начинают улучшаться в течение месяцев после перехода на безглютеновую диету, полное гистологическое выздоровление может занять годы и достигается не у каждого пациента [104,105]. Существуют доказательства, что отсутствие разрешения гистологических изменений может зависеть от продолжающегося употребления в пищу глютена [64].
Безопасный лимит глютена может варьировать у разных пациентов и составляет 10–100 мг в день, хотя данные недавнего исследования показывают, что верхний лимит не должен превышать 50 мг в день [106].
- Чистый, без примесей овес не токсичен для более чем 95% пациентов с целиакией, и используется как составляющая безглютеновой диеты в некоторых странах (например, в Финляндии) для взрослых и детей на протяжении более 15 лет без повышенного риска развития энтеропатии. Существует очень маленькая подгруппа пациентов (< 5%), для которых овес небезопасен [107,108]. В некоторых странах неохотно используют овес, поскольку имеются трудности в гарантировании того, что коммерчески доступный овес не будет иметь примесей других злаковых культур. Следовательно, диета, не включающая в себя овес, может быть рекомендована, по крайней мере, в течение первых месяцев лечения.
- Рис и кукуруза могут быть включены в безглютеновую диету.
Хотя у большинства пациентов наблюдается быстрый клинический ответ на назначение безглютеновой диеты, скорость его варьирует. Пациентам с тяжелой формой заболевания может потребоваться госпитализация, возмещение жидкости и электролитов, внутривенное питание, введение железа, витаминов и, в редких случаях, стероидов [109].
Пациентов нужно побуждать к употреблению естественной пищи с высоким содержанием железа и фолатов, особенно если отмечен дефицит этих минералов. Необходима консультация диетолога, хорошо разбирающегося в безглютеновой диете, особенно в течение первого года после установления диагноза. К сожалению, не все диетологи знакомы с комплексностью безглютеновой диеты, и здесь большую часть информации могут предоставить местные или национальные группы поддержки больных с целиакией.
Поддержка и образование пациента в момент установления диагноза очень важны и должны являться интегральной частью процесса ведения больного [110].
Подростки с целиакией должны быть подготовлены и образованы перед переходом к взрослому лечению и ведению [111].
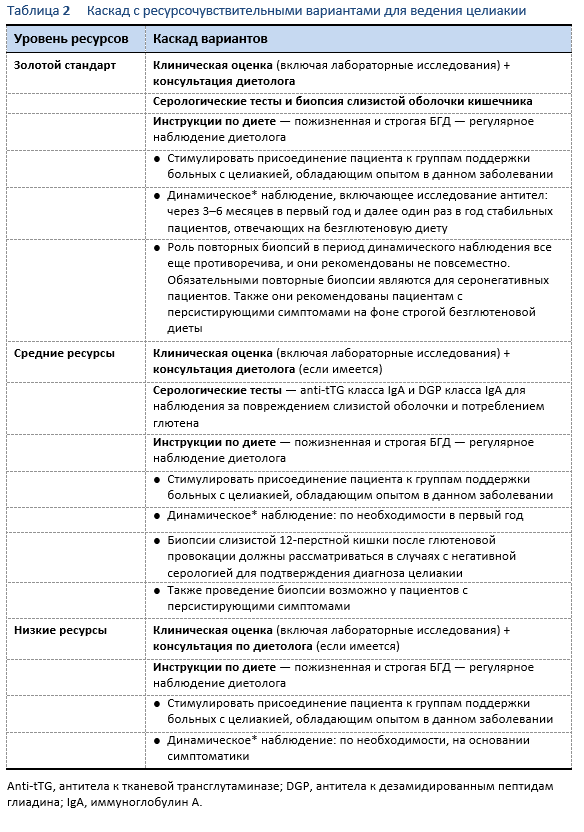
6.1 Рекомендации после установления диагноза
При динамическом наблюдении за целиакией важно иметь в виду принципиальные понятия в момент назначения безглютеновой диеты:
- Серологические тесты не могут выявить минимальное потребление глютена (следы), поэтому необходим междисциплинарный подход к детальному рассмотрению клинической ситуации и назначению безглютеновой диеты. Такая оценка должна проводиться опытными терапевтами и нутриционистами [93,112].
- Эксперты неоднозначно расценивают необходимость проведение повторной биопсии 12-перстной кишки для оценки процесса излечения и приверженности к безглютеновой диете. Хотя данный подход часто используется в практике, не ясно есть ли в нем необходимость для пациентов, клинически ответивших на назначение безглютеновой диеты и имеющих снижающиеся или отрицательные уровни аутоантител. Время проведения повторной биопсии, экспертами ее рекомендующими, четко не обозначается. К тому же полное заживление слизистой оболочки кишечника часто происходит медленно, особенно у взрослых. В обязательном порядке проведение биопсии кишечника должно рассматриваться у пациентов с персистирующими, несмотря на строгую безглютеновую диету, симптомами.
- Продолжающееся потребление глютена в больших или малых количествах (намеренное или случайное) – самая вероятная причина отсутствия ответа на лечение [108,113,114].
Далее следует краткий обзор рекомендаций для динамического наблюдения после установления диагноза и средств для проверки строгой приверженности к безглютеновой диете [9] в течение первого года:
Клиническая оценка: проверять наличия симптомов и проводить лабораторное обследование (т.е., клинический анализ крови с лейкоцитарной формулой, содержание железа, витамин B12, кальций, витамин D) и серологические тесты на целиакию (лучшие на настоящий момент: количественное определение anti-tTG класса IgA и anti-DGP класса IgA) [84,104,115].
- Дети и подростки должны наблюдаться ежегодно (антропометрия, пубертатное развитие, серологические тесты) педиатром или детским гастроэнтерологом до достижения полного физического роста.
- Для определения состояния костной массы должна проводиться денситометрия [116].
- Вакцинация против пневмококков, Haemophilus influenzae, менингококков [117].
- Консультация нутрициониста (совпадает по времени с клиническим визитом): оценка состояния питания и приверженности к безглютеновой диете на основании расспроса, пищевого дневника и частоты приема пищи.
- Пациенту необходимо помочь в присоединении к группе поддержи с опытом борьбы с целиакией — уровень приверженности к диете связан с членством в таких группах и регулярным наблюдением диетолога [118,119].
- Если необходимо и/или требуется должна быть предоставлена психологическая помощь [120].
6.2 БГД
6.2.1 Не разрешено при безглютеновой диете
Зерновые, крахмалы и мука, которые не разрешены при безглютеновой диете [101,121]:
- Ячмень
- Отруби
- Булгур
- Кускус
- Крупка
- Беотийская пшеница (Triticum monococcum)*
- Полба (Triticum dicoccum)*
- Фарро*
- Глютен, мука из клейковины
- Мука Грэма (грубого помола)
- Kamut™ (камут; пшеница Хорасан)*
- Солод, экстракт солода, ароматизатор солода, солодовый сироп
- Овес, овсяные отруби, овсяный сироп — не маркированные как безглютеновые
- Рожь
- Семолина (твердая пшеница)*
- Спельта (динкель, Triticum spelta)
- Тритикале
- Ростки пшеницы, пшеничный крахмал, пшеничные отруби
- Любые продукты, имеющие в названии слова «пшеница», «ячмень» или «рожь»
* Сорта пшеницы
Чистый овес без примесей доступен в некоторых странах и разрешен в определенных количествах. Хотя многие исследования показывают, что умеренное количества овса в пище безопасно для пациентов с целиакией, существуют определенные сомнения о наличии примесей пшеницы и ячменя, которые попадают в овес при обработке.
6.2.2 Разрешено при безглютеновой диете
Безглютеновые зерновые, мука и крахмалы, которые разрешены при безглютеновой диете:
- Амарант
- Маранта
- Мука из бобовых
- Гречка
- Кукуруза
- Нут
- Семечки
- Просо
- Мука монтины (рисовидка индийская)
- Ореховая мука и блюда из орехов
- Овес (без примесей, обозначенный)
- Картофельная мука, картофельный крахмал
- Киноа
- Рис, все сорта (коричневый, белый, сладкий, дикий, жасмин, басмати, клейкий рис, шлифованный рис, рисовые отруби)
- Сорговая мука
- Соевая мука
- Тапиока
- Мука из теффа
Несмотря на то, что эти виды зерновых, муки и крахмалов разрешены при безглютеновой диете, опасение вызывает возможное примешивание к ним пшеницы и ячменя. Таким образом, мука и крахмал должны быть проверены на наличие глютена перед включением в диету пациентов с целиакией. В некоторых странах в интернете периодически публикуются обновляемые списки безглютеновых продуктов, которые были проанализированы на предмет содержания глютена [122,123].
6.2.3 Другие продукты для базовой безглютеновой диеты
- Молочные продукты
- Все виды свежего мяса и мясо, сохраненное без глютена
- Морепродукты
- Яйца
- Бобовые: чечевица, нут (турецкий горох), горох, фасоль, орехи, семечки в упаковках
- Фрукты (свежие, замороженные, консервированные) и натуральные фруктовые соки
- Овощи (свежие, замороженные, консервированные) и натуральные овощные соки
- Жидкие растительные масла
6.2.4 Различные продукты, разрешенные при безглютеновой диете
- Сладости: мед, кукурузный сироп, сахар (коричневый и белый)
- Снеки: чистый попкорн, орехи, чистые разносолы, оливки, безглютеновые картофельные чипсы (картофельные сухарики)
- Приправы: натуральные травы, чистый черный перец, уксусы (яблочный, виноградный или винный)
Приготовление и подготовка пищи: пациенты должны быть проинструктированы не допускать примесей к безглютеновой пище — т.е., использовать отдельные кухонные приборы, кухонные поверхности и тостеры.
Большая часть индустриально изготовленных продуктов содержит запрещенные ингредиенты — важно изучать этикетки и проверять доступные списки разрешенных продуктов. Очень важно входить в поддерживающую группу.
В безглютеновой диете низкое содержание клетчатки. Пациентам нужно рекомендовать увеличивать ее количество, добавляя в диету рис, кукурузу, картофель и большое количество овощей. Все диетические дефициты, такие как дефицит железа, фолиевой кислоты, кальция и (редко) витамина B12, должны быть скорректированы.
6.3 Профилактика — скрининг
В настоящее время нет четких мер по первичной профилактике целиакии, основанных на времени начала потребления глютена новорожденными или длительности грудного вскармливания. Рандомизированные контролируемые исследования не смогли показать необходимость добавления малых количеств глютена [48] или, наоборот, отсрочки от его употребления в возрасте до 12 месяцев [49]. Имеет ли значение количество глютена все еще остается спорным вопросом [51,124,125]. Раннее выявление и лечение являются наиболее проверенными методами вторичной профилактики целиакии [126].
В рамках дебатов об улучшении выявляемости расстройств, связанных с глютеном, некоторые участники предлагают перейти от обнаружения конкретных случаев в группах высокого риска к активной политике серологического тестирования на целиакию в общей популяции [68,127].
6.4 Новые варианты ведения
По мере постепенного понимания этапов иммунопатогенеза целиакии, сейчас многие иммунопатогенетические цели стали доступны для альтернативных/дополнительных методов лечения, таких как внутрикишечное переваривание глютена, улучшение барьерных функций и прием иммуномодуляторов. Многие новые варианты ведения достигли стадии клинических испытаний, но ни один из них пока еще не доступен для клинического применения.
6.5 Мониторинг
6.5.1 Лабораторная оценка
Серологические исследования могут быть полезны при целиакии, снижающиеся концентрации специфичных антител показывают только уменьшение количества глютена и обладают ограниченной способностью четко определять полный эффект лечения. При нормализации антител последующее повышение их уровня считается хорошим показанием переваривания глютена. Конечной мерой эффекта является исчезновение изменений в кишечнике, но этого может не произойти даже при строгом соблюдении безглютеновой диеты.
Периодичность наблюдений: каждые 3–6 месяцев до коррекции измененных показателей в анализах или до клинической стабилизации; затем каждые 1–2 года.
- Исследования показывают, что периодические исследования anti-tTG класса IgA или anti-DGP класса IgA являются наиболее предпочтительным методом мониторинга выполнения указаний врача.
- Хотя эти тесты не выявляют мелких диетических нарушений — нормальные показатели титров нечувствительны к текущему потреблению глютена или к энтеропатии — продолжающееся снижение сывороточных концентраций свидетельствует о приверженности к диете.
- Постоянно находящиеся на границах нормы, повышенные или повышающиеся титры указывают на потребление значительных количеств глютена [64].
6.5.2 Консультация нутрициониста
Интервал: идеально каждые 3–6 месяца до клинической нормализации; затем каждые 1–2 года. Это особенно важно для женщин в детородном возрасте и во время беременности. Консультация опытного диетолога необходима для:
- Оценки текущего состояния питания пациента.
- Для идентификации макронутриентного и/или микронутриентного питания и определения дефицитов и/или излишков веществ.
— Важно чтобы пациенты с целиакией получали хорошо сбалансированную диету, включающую витамины, кальций и клетчатку, на основании консультации специалиста.
- Для анализа пищевых привычек и потенциальных факторов, влияющих на соблюдение диеты.
- Для предоставления информации и назначения безглютеновой диеты.
- Для проведения диетического образования пациента.
- Для наблюдения и оценки соблюдения диеты, а также для повторной беседы о питании.
Пациентам, неспособным придерживаться диеты, может потребоваться поддержка психолога.
6.5.3 Персистирование симптомов
Персистирование симптомов часто связано с продолжающимся потреблением глютена. Распространенной сложностью с безглютеновой диетой являются примеси и неожиданное наличие глютена в обработанных продуктах и/или лекарственных средствах. Глютен широко используется в обработанных пищевых продуктах и, следовательно, может являться скрытым ингредиентом, поэтому разумной тактикой для пациентов будет тщательная проверка состава перед покупкой любого продукта. Если ответ на безглютеновую диету субоптимален, необходимо рассматривать возможность сознательного или случайного потребления глютена. В таких случаях сохранение позитивных результатов серологических исследований может выявить значительные и продолжающиеся нарушения диеты.
Список причин персистирования симптомов у пациентов с целиакией:
- Наслаивающийся синдром раздраженного кишечника или случайное потребление глютена (наиболее частые причины)
- Неверный диагноз
- Первичная непереносимость лактозы
- Пищевая аллергия (кроме пшеницы)
- Недостаточность поджелудочной железы
- Микроскопический колит
- Нарушения бактериального роста
- Воспалительная болезнь кишечника
- Язвенный еюенит*
- Т-клеточная лимфома с энтеропатией*
- Рефрактерная целиакия*
* Это может расцениваться как осложнение длительно протекающей целиакии.
6.6 Переход лечения от детского к взрослому возрасту
Подростки/молодые взрослые с целиакией имеют риск «медицинского» выпадения перед и во время перехода во взрослую сеть здравоохранения [128,129]. В целом, взрослые пациенты с целиакией привыкают сами заботиться о своей диете и быстро обучаются тому, что они могут есть. Подросткам, тем не менее, часто помогают родители и медицинские работники, и они не всегда могут самостоятельно справляться со своим заболеванием. Не существует четких рекомендаций по заполнению пробела между педиатрической и взрослой медицинской помощью при целиакии; в настоящее время рекомендуется организация помощи в переходный период. В этот период необходимо сконцентрироваться на образовании (диета и состояние здоровья), наблюдать за течением заболевания и справляться с возможными психологическими трудностями [111].
6.7 Рефрактерная целиакия
Рефрактерная целиакия описывается как персистенция (или рецидив) клинических симптомов и гистопатологических изменений в ассоциации с клиническими симптомами несмотря на строгую безглютеновую диету в течение 12 месяцев [108]. Она может выявляться при обращении (первичная) или после начала безглютеновой диеты (вторичная) [130]. Особенно о рефрактерной целиакии нужно помнить у пациентов, которым диагноз заболевания был установлен в возрасте старше 50 лет.
Существует два подтипа рефрактерной целиакии:
- Тип I, с фенотипически нормальными интраэпителиальными лимфоцитами
- Тип II, с клональным распространением интраэпителиальных лимфоцитов и аберрантным фенотипом с отсутствием поверхностных рецепторов CD3, CD8 и T-клеточных рецепторов
Заболевание тип II рассматривается как низкодифференцированная форма интраэпителиальной лимфомы, проявляющаяся тяжелой мальабсорбцией, которая не отвечает на безглютеновую диету. Это – самая тяжелая форма, которая связана с высоким уровнем смертности [131].
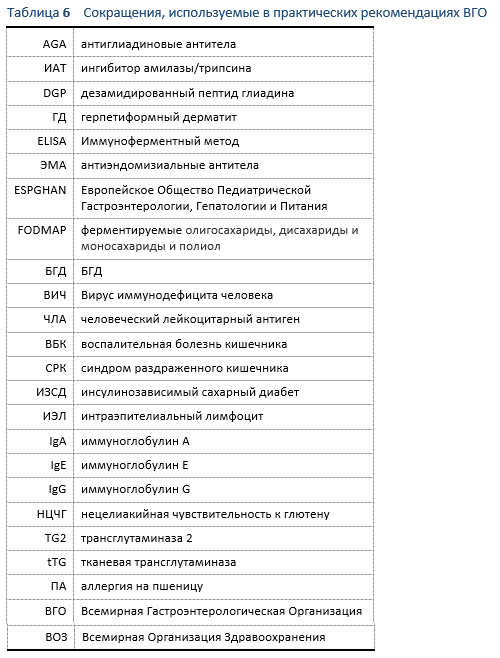
7.1 Сокращения
7.2 Практические рекомендации золотого стандарт
- 2016:
Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Ludvigsson et al. Gut 2016;65:1242–51 [111].
- 2014:
Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Ludvigsson et al. Gut 2014;63:1210–28 [63].
- 2013:
ACG clinical guidelines: diagnosis and management of celiac disease. Rubio-Tapia et al. Am J Gastroenterol 2013;108:656–76; quiz 677. doi: 10.1038/ajg.2013.79 [132].
- 2012:
European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. Husby et al. J Pediatr Gastroenterol Nutr 2012;54:136–60 [87].
- 2005:
Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Hill et al. J Pediatr Gastroenterol Nutr 2005;40:1–19 [67].
7.3 Ссылкиа
1. Stern M, Ciclitira PJ, van Eckert R, Feighery C, Janssen FW, Méndez E, et al. Analysis and clinical effects of gluten in coeliac disease. Eur J Gastroenterol Hepatol 2001;13(6):741–7.
2. Jabri B, Sollid LM. Mechanisms of disease: immunopathogenesis of celiac disease. Nat Clin Pract Gastroenterol Hepatol 2006;3(9):516–25.
3. Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PHR, et al. The Oslo definitions for coeliac disease and related terms. Gut 2013;62(1):43–52.
4. Cianferoni A. Wheat allergy: diagnosis and management. J Asthma Allergy 2016;13.
5. Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PHR, Hadjivassiliou M, et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Med 2012;10:13.
6. Carroccio A, Mansueto P, Iacono G, Soresi M, D’Alcamo A, Cavataio F, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012;107(12):1898–906.
7. Biesiekierski JR, Newnham ED, Irving PM, Barrett JS, Haines M, Doecke JD, et al. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial. Am J Gastroenterol 2011;106(3):508–14.
8. Biesiekierski JR, Peters SL, Newnham ED, Rosella O, Muir JG, Gibson PR. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology 2013;145(2):320–328.e3.
9. Di Sabatino A, Volta U, Salvatore C, Biancheri P, Caio G, De Giorgio R, et al. Small amounts of gluten in subjects with suspected nonceliac gluten sensitivity: a randomized, double-blind, placebo-controlled, cross-over trial. Clin Gastroenterol Hepatol 2015;13(9):1604–1612.e3.
10. Shahbazkhani B, Sadeghi A, Malekzadeh R, Khatavi F, Etemadi M, Kalantri E, et al. Non-celiac gluten sensitivity has narrowed the spectrum of irritable bowel syndrome: a double-blind randomized placebo-controlled trial. Nutrients 2015;7(6):4542–54.
11. Carroccio A, D’Alcamo A, Mansueto P. Nonceliac wheat sensitivity in the context of multiple food hypersensitivity: new data from confocal endomicroscopy. Gastroenterology 2015;148(3):666–7.
12. Guandalini S, Polanco I. Nonceliac gluten sensitivity or wheat intolerance syndrome? J Pediatr 2015;166(4):805–11.
13. Lohi S, Mustalahti K, Kaukinen K, Laurila K, Collin P, Rissanen H, et al. Increasing prevalence of coeliac disease over time. Aliment Pharmacol Ther 2007;26(9):1217–25.
14. Choung RS, Ditah IC, Nadeau AM, Rubio-Tapia A, Marietta EV, Brantner TL, et al. Trends and racial/ethnic disparities in gluten-sensitive problems in the United States: findings from the National Health and Nutrition Examination Surveys from 1988 to 2012. Am J Gastroenterol 2015;110(3):455–61.
15. Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology 2001;120(3):636–51.
16. Fasano A, Berti I, Gerarduzzi T, Not T, Colletti RB, Drago S, et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med 2003;163(3):286–92.
17. Lionetti E, Catassi C. New clues in celiac disease epidemiology, pathogenesis, clinical manifestations, and treatment. Int Rev Immunol 2011;30(4):219–31.
18. Tortora R, Zingone F, Rispo A, Bucci C, Capone P, Imperatore N, et al. Coeliac disease in the elderly in a tertiary centre. Scand J Gastroenterol 2016;51(10):1179–83.
19. Smecuol E, Mauriño E, Vazquez H, Pedreira S, Niveloni S, Mazure R, et al. Gynaecological and obstetric disorders in coeliac disease: frequent clinical onset during pregnancy or the puerperium. Eur J Gastroenterol Hepatol 1996;8(1):63–89.
20. Marsh MN. Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity (“celiac sprue”). Gastroenterology 1992;102(1):330–54.
21. Gomez JC, Selvaggio GS, Viola M, Pizarro B, la Motta G, de Barrio S, et al. Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area. Am J Gastroenterol 2001;96(9):2700–4.
22. Gandolfi L, Pratesi R, Cordoba JC, Tauil PL, Gasparin M, Catassi C. Prevalence of celiac disease among blood donors in Brazil. Am J Gastroenterol 2000;95(3):689–92.
23. Parada A, Araya M, Pérez-Bravo F, Méndez M, Mimbacas A, Motta P, et al. Amerindian mtDNA haplogroups and celiac disease risk HLA haplotypes in mixed-blood Latin American patients. J Pediatr Gastroenterol Nutr 2011;53(4):429–34.
24. Barada K, Abu Daya H, Rostami K, Catassi C. Celiac disease in the developing world. Gastrointest Endosc Clin N Am 2012;22(4):773–96.
25. Brar P, Lee AR, Lewis SK, Bhagat G, Green PHR. Celiac disease in African-Americans. Dig Dis Sci 2006;51(5):1012–5.
26. Catassi C, Rätsch IM, Gandolfi L, Pratesi R, Fabiani E, El Asmar R, et al. Why is coeliac disease endemic in the people of the Sahara? Lancet 1999;354(9179):647–8.
27. Sood A, Midha V, Sood N, Avasthi G, Sehgal A. Prevalence of celiac disease among school children in Punjab, North India. J Gastroenterol Hepatol 2006;21(10):1622–5.
28. Aziz S, Muzaffar R, Zafar MN, Mehnaz A, Mubarak M, Abbas Z, et al. Celiac disease in children with persistent diarrhea and failure to thrive. J Coll Physicians Surg Pak 2007;17(9):554–7.
29. Diallo I, Coton T. Celiac disease: a challenging disease uneasy to diagnose in Sub-Saharan Africa. J Gastroenterol Hepatol Res [Internet] 2013;2(8):753–6. Available at: http://www.ghrnet.org/index.php/joghr/article/view/459.
30. Ageep AK. Celiac disease in the Red Sea state of Sudan. Trop Gastroenterol 2012;33(2):118–22.
31. Mohammed IM, Karrar ZEA, El-Safi SH. Coeliac disease in Sudanese children with clinical features suggestive of the disease. East Mediterr Health J 2006;12(5):582–9.
32. Wu J, Xia B, von Blomberg BME, Zhao C, Yang XW, Crusius JBA, et al. Coeliac disease: emerging in China? Gut 2010;59(3):418–9.
33. Singh P, Arora S, Singh A, Strand TA, Makharia GK. Prevalence of celiac disease in Asia: a systematic review and meta-analysis. J Gastroenterol Hepatol 2016;31(6):1095–101.
34. Vázquez H, de la Paz Temprano M, Sugai E, Scacchi SM, Souza C, Cisterna D, et al. Prevalence of celiac disease and celiac autoimmunity in the Toba native Amerindian community of Argentina. Can J Gastroenterol Hepatol 2015;29(8):431–4.
35. Lionetti E, Gatti S, Pulvirenti A, Catassi C. Celiac disease from a global perspective. Best Pract Res Clin Gastroenterol 2015;29(3):365–79.
36. Catassi C, Kryszak D, Bhatti B, Sturgeon C, Helzlsouer K, Clipp SL, et al. Natural history of celiac disease autoimmunity in a USA cohort followed since 1974. Ann Med 2010;42(7):530–8.
37. Mäki M, Mustalahti K, Kokkonen J, Kulmala P, Haapalahti M, Karttunen T, et al. Prevalence of Celiac disease among children in Finland. N Engl J Med 2003;348(25):2517–24.
38. Green PHR. The many faces of celiac disease: clinical presentation of celiac disease in the adult population. Gastroenterology 2005;128(4 Suppl 1):S74-78.
39. Dickey W, McMillan SA, Hughes DF. Identification of coeliac disease in primary care. Scand J Gastroenterol 1998;33(5):491–3.
40. Collin P, Huhtala H, Virta L, Kekkonen L, Reunala T. Diagnosis of celiac disease in clinical practice: physician’s alertness to the condition essential. J Clin Gastroenterol 2007;41(2):152–6.
41. Rostami-Nejad M, Romanos J, Rostami K, Ganji A, Ehsani-Ardakani MJ, Bakhshipour AR, et al. Allele and haplotype frequencies for HLA-DQ in Iranian celiac disease patients. World J Gastroenterol 2014;20(20):6302–8.
42. Gutierrez-Achury J, Zhernakova A, Pulit SL, Trynka G, Hunt KA, Romanos J, et al. Fine mapping in the MHC region accounts for 18% additional genetic risk for celiac disease. Nat Genet 2015;47(6):577–8.
43. Romanos J, van Diemen CC, Nolte IM, Trynka G, Zhernakova A, Fu J, et al. Analysis of HLA and non-HLA alleles can identify individuals at high risk for celiac disease. Gastroenterology 2009;137(3):834–40, 840–3.
44. Liu E, Lee HS, Aronsson CA, Hagopian WA, Koletzko S, Rewers MJ, et al. Risk of pediatric celiac disease according to HLA haplotype and country. N Engl J Med 2014;371(1):42–9.
45. Polvi A, Arranz E, Fernandez-Arquero M, Collin P, Mäki M, Sanz A, et al. HLA-DQ2-negative celiac disease in Finland and Spain. Hum Immunol 1998;59(3):169–75.
46. Spurkland A, Sollid LM, Polanco I, Vartdal F, Thorsby E. HLA-DR and -DQ genotypes of celiac disease patients serologically typed to be non-DR3 or non-DR5/7. Hum Immunol 1992;35(3):188–92.
47. Abadie V, Sollid LM, Barreiro LB, Jabri B. Integration of genetic and immunological insights into a model of celiac disease pathogenesis. Annu Rev Immunol 2011;29:493–525.
48. Vriezinga SL, Auricchio R, Bravi E, Castillejo G, Chmielewska A, Crespo Escobar P, et al. Randomized feeding intervention in infants at high risk for celiac disease. N Engl J Med 2014;371(14):1304–15.
49. Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, et al. Introduction of gluten, HLA status, and the risk of celiac disease in children. N Engl J Med 2014;371(14):1295–303.
50. Aronsson CA, Lee HS, Liu E, Uusitalo U, Hummel S, Yang J, et al. Age at gluten introduction and risk of celiac disease. Pediatrics 2015;135(2):239–45.
51. Andrén Aronsson C, Lee HS, Koletzko S, Uusitalo U, Yang J, Virtanen SM, et al. Effects of gluten intake on risk of celiac disease: a case-control study on a Swedish birth cohort. Clin Gastroenterol Hepatol 2016;14(3):403–409.e3.
52. Szajewska H, Shamir R, Chmielewska A, Pieścik-Lech M, Auricchio R, Ivarsson A, et al. Systematic review with meta-analysis: early infant feeding and coeliac disease—update 2015. Aliment Pharmacol Ther 2015;41(11):1038–54.
53. Ferguson A, Arranz E, O’Mahony S. Clinical and pathological spectrum of coeliac disease—active, silent, latent, potential. Gut 1993;34(2):150–1.
54. Green PHR, Jabri B. Coeliac disease. Lancet 2003;362(9381):383–91.
55. Santonicola A, Iovino P, Cappello C, Capone P, Andreozzi P, Ciacci C. From menarche to menopause: the fertile life span of celiac women. Menopause 2011;18(10):1125–30.
56. Sbai W, Bourgain G, Luciano L, Brardjanian S, Thefenne L, Al Shukry A, et al. Celiac crisis in a multi-trauma adult patient. Clin Res Hepatol Gastroenterol 2016;40(3):e31–2.
57. Korpimäki S, Kaukinen K, Collin P, Haapala A-M, Holm P, Laurila K, et al. Gluten-sensitive hypertransaminasemia in celiac disease: an infrequent and often subclinical finding. Am J Gastroenterol 2011;106(9):1689–96.
58. Nachman F, Mauriño E, Vázquez H, Sfoggia C, Gonzalez A, Gonzalez V, et al. Quality of life in celiac disease patients: prospective analysis on the importance of clinical severity at diagnosis and the impact of treatment. Dig Liver Dis 2009;41(1):15–25.
59. Lindfors K, Koskinen O, Kaukinen K. An update on the diagnostics of celiac disease. Int Rev Immunol 2011;30(4):185–96.
60. Kinos S, Kurppa K, Ukkola A, Collin P, Lähdeaho ML, Huhtala H, et al. Burden of illness in screen-detected children with celiac disease and their families. J Pediatr Gastroenterol Nutr 2012;55(4):412–6.
61. Kurppa K, Paavola A, Collin P, Sievänen H, Laurila K, Huhtala H, et al. Benefits of a gluten-free diet for asymptomatic patients with serologic markers of celiac disease. Gastroenterology 2014;147(3):610–617.e1.
62. Giersiepen K, Lelgemann M, Stuhldreher N, Ronfani L, Husby S, Koletzko S, et al. Accuracy of diagnostic antibody tests for coeliac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr 2012;54(2):229–41.
63. Ludvigsson JF, Bai JC, Biagi F, Card TR, Ciacci C, Ciclitira PJ, et al. Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology. Gut 2014;63(8):1210–28.
64. Kelly CP, Bai JC, Liu E, Leffler DA. Advances in diagnosis and management of celiac disease. Gastroenterology 2015;148(6):1175–86.
65. Catassi C, Fasano A. Celiac disease diagnosis: simple rules are better than complicated algorithms. Am J Med 2010;123(8):691–3.
66. Ciclitira PJ, King AL, Fraser JS. AGA technical review on Celiac Sprue. American Gastroenterological Association. Gastroenterology 2001;120(6):1526–40.
67. Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005;40(1):1–19.
68. Ludvigsson JF, Card TR, Kaukinen K, Bai J, Zingone F, Sanders DS, et al. Screening for celiac disease in the general population and in high-risk groups. United Eur Gastroenterol J 2015;3(2):106–20.
69. Singh P, Arora S, Lal S, Strand TA, Makharia GK. Risk of celiac disease in the first- and second-degree relatives of patients with celiac disease: a systematic review and meta-analysis. Am J Gastroenterol 2015;110(11):1539–48.
70. Oxentenko AS, Grisolano SW, Murray JA, Burgart LJ, Dierkhising RA, Alexander JA. The insensitivity of endoscopic markers in celiac disease. Am J Gastroenterol 2002;97(4):933–8.
71. Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, et al. Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement. Gastrointest Endosc 1998;47(3):223–9.
72. Marsh MN, W Johnson M, Rostami K. Mucosal histopathology in celiac disease: a rebuttal of Oberhuber’s sub-division of Marsh III. Gastroenterol Hepatol Bed Bench 2015;8(2):99–109.
73. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol 1999;11(10):1185–94.
74. Mooney PD, Kurien M, Evans KE, Rosario E, Cross SS, Vergani P, et al. Clinical and immunologic features of ultra-short celiac disease. Gastroenterology 2016;150(5):1125–34.
75. Leffler D, Schuppan D, Pallav K, Najarian R, Goldsmith JD, Hansen J, et al. Kinetics of the histological, serological and symptomatic responses to gluten challenge in adults with coeliac disease. Gut 2013;62(7):996–1004.
76. Rostami K, Kerckhaert J, Tiemessen R, von Blomberg BM, Meijer JW, Mulder CJ. Sensitivity of antiendomysium and antigliadin antibodies in untreated celiac disease: disappointing in clinical practice. Am J Gastroenterol 1999;94(4):888–94.
77. Corazza GR, Villanacci V. Coeliac disease. J Clin Pathol 2005;58(6):573–4.
78. Rostom A, Dubé C, Cranney A, Saloojee N, Sy R, Garritty C, et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology 2005;128(4 Suppl 1):S38-46.
79. Leffler DA, Schuppan D. Update on serologic testing in celiac disease. Am J Gastroenterol 2010;105(12):2520–4.
80. Chorzelski TP, Beutner EH, Sulej J, Tchorzewska H, Jablonska S, Kumar V, et al. IgA anti-endomysium antibody. A new immunological marker of dermatitis herpetiformis and coeliac disease. Br J Dermatol 1984;111(4):395–402.
81. Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nat Med 1997;3(7):797–801.
82. Sugai E, Moreno ML, Hwang HJ, Cabanne A, Crivelli A, Nachman F, et al. Celiac disease serology in patients with different pretest probabilities: is biopsy avoidable? World J Gastroenterol 2010;16(25):3144–52.
83. Bufler P, Heilig G, Ossiander G, Freudenberg F, Grote V, Koletzko S. Diagnostic performance of three serologic tests in childhood celiac disease. Z Gastroenterol 2015;53(2):108–14.
84. Nachman F, Sugai E, Vázquez H, González A, Andrenacci P, Niveloni S, et al. Serological tests for celiac disease as indicators of long-term compliance with the gluten-free diet. Eur J Gastroenterol Hepatol 2011;23(6):473–80.
85. Weile B, Hansen BF, Hägerstrand I, Hansen JP, Krasilnikoff PA. Interobserver variation in diagnosing coeliac disease. A joint study by Danish and Swedish pathologists. APMIS 2000;108(5):380–4.
86. Webb C, Norström F, Myléus A, Ivarsson A, Halvarsson B, Högberg L, et al. Celiac disease can be predicted by high levels of anti-tissue transglutaminase antibodies in population-based screening. J Pediatr Gastroenterol Nutr 2015;60(6):787–91.
87. Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54(1):136–60.
88. Sandström O, Rosén A, Lagerqvist C, Carlsson A, Hernell O, Högberg L, et al. Transglutaminase IgA antibodies in a celiac disease mass screening and the role of HLA-DQ genotyping and endomysial antibodies in sequential testing. J Pediatr Gastroenterol Nutr 2013;57(4):472–6.
89. Sugai E, Hwang HJ, Vázquez H, Moreno ML, Costa F, Longarini G, et al. Should ESPGHAN guidelines for serologic diagnosis of celiac disease be used in adults? A prospective analysis in an adult patient cohort with high pretest probability. Am J Gastroenterol 2015;110(10):1504–5.
90. Oyaert M, Vermeersch P, De Hertogh G, Hiele M, Vandeputte N, Hoffman I, et al. Combining antibody tests and taking into account antibody levels improves serologic diagnosis of celiac disease. Clin Chem Lab Med 2015;53(10):1537–46.
91. Newnham ED, Shepherd SJ, Strauss BJ, Hosking P, Gibson PR. Adherence to the gluten-free diet can achieve the therapeutic goals in almost all patients with coeliac disease: a 5-year longitudinal study from diagnosis. J Gastroenterol Hepatol 2016;31(2):342–9.
92. Kurppa K, Collin P, Mäki M, Kaukinen K. Celiac disease and health-related quality of life. Expert Rev Gastroenterol Hepatol 2011;5(1):83–90.
93. Nachman F, del Campo MP, González A, Corzo L, Vázquez H, Sfoggia C, et al. Long-term deterioration of quality of life in adult patients with celiac disease is associated with treatment noncompliance. Dig Liver Dis 2010;42(10):685–91.
94. Cranney A, Rostom A, Sy R, Dubé C, Saloogee N, Garritty C, et al. Consequences of testing for celiac disease. Gastroenterology 2005;128(4 Suppl 1):S109–20.
95. Brousse N, Meijer JWR. Malignant complications of coeliac disease. Best Pract Res Clin Gastroenterol 2005;19(3):401–12.
96. Anderson LA, Gadalla S, Morton LM, Landgren O, Pfeiffer R, Warren JL, et al. Population-based study of autoimmune conditions and the risk of specific lymphoid malignancies. Int J Cancer 2009;125(2):398–405.
97. Corazza GR, Di Stefano M, Mauriño E, Bai JC. Bones in coeliac disease: diagnosis and treatment. Best Pract Res Clin Gastroenterol 2005;19(3):453–65.
98. Olmos M, Antelo M, Vazquez H, Smecuol E, Mauriño E, Bai JC. Systematic review and meta-analysis of observational studies on the prevalence of fractures in coeliac disease. Dig Liver Dis 2008;40(1):46–53.
99. Saccone G, Berghella V, Sarno L, Maruotti GM, Cetin I, Greco L, et al. Celiac disease and obstetric complications: a systematic review and metaanalysis. Am J Obstet Gynecol 2016;214(2):225–34.
100. Green PHR, Cellier C. Celiac disease. N Engl J Med 2007;357(17):1731–43.
101. Ciacci C, Ciclitira P, Hadjivassiliou M, Kaukinen K, Ludvigsson JF, McGough N, et al. The gluten-free diet and its current application in coeliac disease and dermatitis herpetiformis. United Eur Gastroenterol J 2015;3(2):121–35.
102. Collin P. Should adults be screened for celiac disease? What are the benefits and harms of screening? Gastroenterology 2005;128(4 Suppl 1):S104–8.
103. Hoffenberg EJ. Should all children be screened for celiac disease? Gastroenterology 2005;128(4 Suppl 1):S98–103.
104. Sugai E, Nachman F, Váquez H, González A, Andrenacci P, Czech A, et al. Dynamics of celiac disease-specific serology after initiation of a gluten-free diet and use in the assessment of compliance with treatment. Dig Liver Dis 2010;42(5):352–8.
105. Moreno M de L, Cebolla Á, Muñoz-Suano A, Carrillo-Carrion C, Comino I, Pizarro Á, et al. Detection of gluten immunogenic peptides in the urine of patients with coeliac disease reveals transgressions in the gluten-free diet and incomplete mucosal healing. Gut 2015 Nov 25. doi: 10.1136/gutjnl-2015-310148 [Epub ahead of print].
106. Forbes GM. If only my celiac patients and I knew that…. Clin Gastroenterol Hepatol 2015;13(3):614–5.
107. Pulido OM, Gillespie Z, Zarkadas M, Dubois S, Vavasour E, Rashid M, et al. Introduction of oats in the diet of individuals with celiac disease: a systematic review. Adv Food Nutr Res 2009;57:235–85.
108. Akobeng AK, Thomas AG. Systematic review: tolerable amount of gluten for people with coeliac disease. Aliment Pharmacol Ther 2008;27(11):1044–52.
109. Ciacci C, Maiuri L, Russo I, Tortora R, Bucci C, Cappello C, et al. Efficacy of budesonide therapy in the early phase of treatment of adult coeliac disease patients with malabsorption: an in vivo/in vitro pilot study. Clin Exp Pharmacol Physiol 2009;36(12):1170–6.
110. Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, et al. Support for patients with celiac disease: a literature review. United Eur Gastroenterol J 2015;3(2):146–59.
111. Ludvigsson JF, Agreus L, Ciacci C, Crowe SE, Geller MG, Green PHR, et al. Transition from childhood to adulthood in coeliac disease: the Prague consensus report. Gut 2016;65(8):1242–51.
112. Haines ML, Anderson RP, Gibson PR. Systematic review: the evidence base for long-term management of coeliac disease. Aliment Pharmacol Ther 2008;28(9):1042–66.
113. Leffler DA, Edwards George JB, Dennis M, Cook EF, Schuppan D, Kelly CP. A prospective comparative study of five measures of gluten-free diet adherence in adults with coeliac disease. Aliment Pharmacol Ther 2007;26(9):1227–35.
114. Hollon JR, Cureton PA, Martin ML, Puppa ELL, Fasano A. Trace gluten contamination may play a role in mucosal and clinical recovery in a subgroup of diet-adherent non-responsive celiac disease patients. BMC Gastroenterol 2013;13:40.
115. Ciacci C, Cavallaro R, della Valle N, d’Argenio G. The use of serum tTG-ab assay in patients on gluten-free diet as a measure of dietetic compliance. Gastroenterology 2002;122(2):588.
116. García-Manzanares A, Tenias JM, Lucendo AJ. Bone mineral density directly correlates with duodenal Marsh stage in newly diagnosed adult celiac patients. Scand J Gastroenterol 2012;47(8–9):927–36.
117. Zingone F, Abdul Sultan A, Crooks CJ, Tata LJ, Ciacci C, West J. The risk of community-acquired pneumonia among 9803 patients with coeliac disease compared to the general population: a cohort study. Aliment Pharmacol Ther 2016;44(1):57–67.
118. Hall NJ, Rubin G, Charnock A. Systematic review: adherence to a gluten-free diet in adult patients with coeliac disease. Aliment Pharmacol Ther 2009;30(4):315–30.
119. Leffler DA, Edwards-George J, Dennis M, Schuppan D, Cook F, Franko DL, et al. Factors that influence adherence to a gluten-free diet in adults with celiac disease. Dig Dis Sci 2008;53(6):1573–81.
120. Ciacci C, Iavarone A, Siniscalchi M, Romano R, De Rosa A. Psychological dimensions of celiac disease: toward an integrated approach. Dig Dis Sci 2002;47(9):2082–7.
121. Niewinski MM. Advances in celiac disease and gluten-free diet. J Am Diet Assoc 2008;108(4):661–72.
122. Pinto-Sanchez MI, Verdu EF, Gordillo MC, Bai JC, Birch S, Moayyedi P, et al. Tax-deductible provisions for gluten-free diet in Canada compared with systems for gluten-free diet coverage available in various countries. Can J Gastroenterol Hepatol 2015;29(2):104–10.
123. Republic of Argentina. National Ministry of Health. [Clinical practice guidelines on diagnosis and treatment of celiac disease. Detection and National Celiac Disease Control. Official Gazette No. 32148]. May 2011. [Internet]. Available at: http://www.msal.gob.ar.
124. Chmielewska A, Pieścik-Lech M, Szajewska H, Shamir R. Primary prevention of celiac disease: environmental factors with a focus on early nutrition. Ann Nutr Metab 2015;67 Suppl 2:43–50.
125. Szajewska H, Shamir R, Mearin L, Ribes-Koninckx C, Catassi C, Domellöf M, et al. Gluten introduction and the risk of coeliac disease: a position paper by the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2016;62(3):507–13.
126. Mearin ML. The prevention of coeliac disease. Best Pract Res Clin Gastroenterol 2015;29(3):493–501.
127. Catassi C, Fasano A. Coeliac disease. The debate on coeliac disease screening—are we there yet? Nat Rev Gastroenterol Hepatol 2014;11(8):457–8.
128. O’Leary C, Wieneke P, Healy M, Cronin C, O’Regan P, Shanahan F. Celiac disease and the transition from childhood to adulthood: a 28-year follow-up. Am J Gastroenterol 2004;99(12):2437–41.
129. Mozer-Glassberg Y, Zevit N, Rosenbach Y, Hartman C, Morgenstern S, Shamir R. Follow-up of children with celiac disease—lost in translation? Digestion 2011;83(4):283–7.
130. Cellier C, Delabesse E, Helmer C, Patey N, Matuchansky C, Jabri B, et al. Refractory sprue, coeliac disease, and enteropathy-associated T-cell lymphoma. French Coeliac Disease Study Group. Lancet 2000;356(9225):203–8.
131. Rubio-Tapia A, Murray JA. Classification and management of refractory coeliac disease. Gut 2010;59(4):547–57.
132. Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol 2013;108(5):656–76.